
水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:3Fe2+ + 2S2O32- + O2 + aOH-= Y+ S4O62- + 2H2O,下列说法中不正确的是
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.S2O32-是还原剂
D.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届广东省广州市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
用下图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是
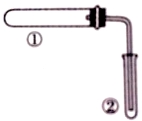
| ①中实验 | ②中现象 |
A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:选择题
下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.NH3(g)+O2(g) NO(g)+H2O(g) ΔH=-a kJ·mol-1
NO(g)+H2O(g) ΔH=-a kJ·mol-1
B.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
C.2CO(g)+O2(g) 2CO2(g) ΔH=-c kJ·mol-1
2CO2(g) ΔH=-c kJ·mol-1
D.CH3CH2OH(l)+O2(g) CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:填空题
C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
离子半径 | 酸性 | 还原性 | 得电子能力 |
N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)① CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
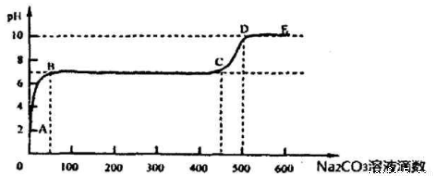
请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如右图所示,
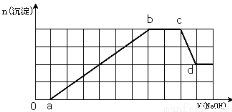
下列说法正确的是
A.d点溶液中含有的溶质只有Na2SO4
B.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,
Mg2++2OH-= Mg(OH)2↓
D.原溶液中含有的阳离子必定有H+、NH4+、Al3+, 且Mg2+和Fe3+至少存在一种
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
下列各溶液中,一定能大量共存的是
A.Fe3+、Na+、SO42-、H2O2B.C2H5OH、MnO4-、H+ 、K+
C.Pb2+、K+ 、SO42-、Cl- D.Na+、SO32- 、CH3COO-、S2-
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.3化学平衡移动试卷(解析版) 题型:选择题
反应2X(g)+Y(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )
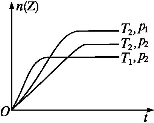
A.T1<T2,p1<p2B.T1<T2,p1>p2 C.T1>T2,p1>p2D.T1>T2,p1<p2
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
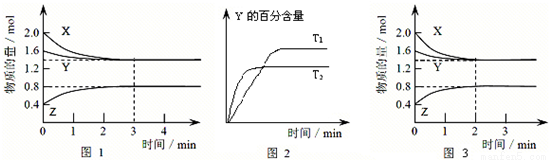
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·L-1·min-1
B.容器中发生的反应可表示为:3X(g)+Y(g) = 2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com