
| A.电子层数逐渐增多 |
| B.最高价氧化物的水化物的碱性减弱,酸性增强 |
| C.最高正化合价数值逐渐增大 |
| D.从硅到氯,最低负化合价从-4到-1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.中子数为1 | B.质子数为2 |
| C.质量数为3 | D.原子结构示意图是 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
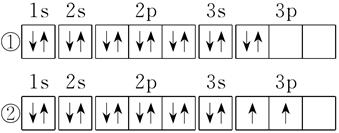
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com