

 .
. .
.分析 A、B、C、D、E五种元素都是短周期主族元素,按原子序数依次递增,其中A、C同主族,五种元素中只有C元素为金属元素,且C元素是短周期元素中金属性最活泼的元素为Na,B元素的最高价与最低价的代数和为0为C,则A为H,D元素原子的电子层结构中K层与M层的电子数之和等于L层电子数,最外层电子数为6,判断D为S,E为Cl,
(1)元素E为氯元素,原子核外三个电子层,最外层7个电子层,最高价为+7价,氧元素为-2价,据此写出氧化物化学式;
(2)电子层数越多原子半径越大,同周期原子半径依次减小;
(3)CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,据此书写即可;
(4)能证明D与E的非金属性强弱的事实是氯气氧化性大于硫单质;
(5)化学中常在元素符号周围用小黑点“•”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式,用电子式表示化合物形成过程时,应先判定化合物类型,若为离子化合物,则用箭头表示电子的移动,若为共价化合物,则不需要箭头表示.A与E形成的化合物位HCl,为共价化合物,C与D形成的化合物为硫化钠为离子化合物,据此书写电子式形成过程;
(6)元素E的单质氯气有毒,可用C的最高价氧化物对应的水化物为氢氧化钠的溶液吸收,氯气和氢氧化溶液反应生成氯化钠、次氯酸钠和水;
(7)元素F与C同周期,F元素在周期表中所在周期数等于族序数为Al,F单质能与C的最高价氧化物对应的水化物发生反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A、B、C、D、E五种元素都是短周期主族元素,按原子序数依次递增,其中A、C同主族,五种元素中只有C元素为金属元素,且C元素是短周期元素中金属性最活泼的元素为Na,B元素的最高价与最低价的代数和为0为C,则A为H,D元素原子的电子层结构中K层与M层的电子数之和等于L层电子数,最外层电子数为6,判断为S,E为Cl,
(1)元素E为氯元素,原子核外三个电子层,最外层7个电子层,位于周期表的第三周期第ⅦA,最高价为+7价,氧元素为-2价,据此写出氧化物化学式为Cl2O7,
故答案为:3;ⅦA;Cl2O7;
(2)电子层数越多原子半径越大,同周期原子半径依次减小,A、B、C、D、E五种元素的原子半径由大到小的顺序是Na>S>Cl>C>H,
故答案为:Na>S>Cl>C>H;
(3)CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为 ,
,
故答案为: ;
;
(4)能证明D与E的非金属性强弱的事实是氯气氧化性大于硫单质,反应的化学方程式为:H2S+CI2=2HCI+S↓,
故答案为:H2S+CI2=2HCI+S↓;
(5)HCl为共价化合物,在由H原子和Cl原子形成HCl的过程中,只有电子对的共用而无电子的得失,故其形成过程不能标箭头,且HCl是由原子过程的,无离子,故形成过程应为 ,硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为:
,硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: .
.
故答案为: ;
; ;
;
(6)元素E的单质氯气有毒,可用C的最高价氧化物对应的水化物为氢氧化钠的溶液吸收,氯气和氢氧化溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(7)元素F与C同周期,F元素在周期表中所在周期数等于族序数为Al,F单质能与C的最高价氧化物对应的水化物发生反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查了周期表中原子结构、元素判断、电子式书写、物质性质等掌握基础是解题关键,题目难度中等.


科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:选择题
在含2.408×1024个Na+的Na2SO4的物质的量是
A.0.1mol B.0.5 mol C.1 mol D.2 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
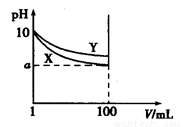
A.X、Y两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.分别完全中和X、Y这两种碱溶液时,消耗同
浓度盐酸的体积Vx>Vy
D.若8<a<10,则X、Y都是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
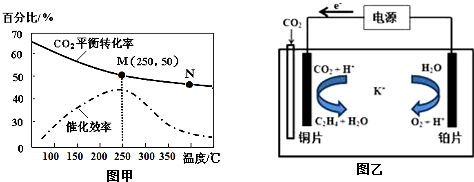
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.
已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):加一些水、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- | |
| B. | 加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO42- | |
| C. | 向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl- | |
| D. | 已知丙酮是无色液体,不溶于水,密度小于水,分离水和丙酮的最合理方法为蒸馏或蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器甲中分子总数多 | B. | 容器甲中C的浓度大 | ||
| C. | 容器甲中反应速率快 | D. | 容器甲中转化率大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com