
| A. | 2 mol HI(g) | B. | 2 mol H2(g)和1 mol I2(g) | ||
| C. | 1 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |
分析 等温等容条件下,对于反应前后气体物质的量不变的反应,经过等价转化只要最初加入的物质的量之比与原平衡相等,就会建立等效平衡,平衡时各物质的体积分数相同,由此分析解答.
解答 解:等温等容条件下,对于反应前后气体物质的量不变的反应,经过等价转化只要最初加入的物质的量之比与原平衡相等,就会建立等效平衡,平衡时各物质的体积分数相同.题干起始n(H2):n(I2)=1:1,
A、起始2 mol HI(g)转化为:n(H2):n(I2)=1:1,能建立等效平衡,故A正确;
B、加2 mol H2(g)和1 mol I2(g)则是n(H2):n(I2)=2:1,不能建立等效平衡,故B错误;
C、起始n(H2):n(I2)=1:2,不能建立等效平衡,故C错误;
D、起始加入1 mol I2(g)和2 mol HI(g)相当于起始加入1 mol H2和2 mol I2(g),n(H2):n(I2)=1:2,不能建立等效平衡,故D错误;
故选A.
点评 本题考查两边计量数相等的等效平衡判断,难度中等,理解等效平衡规律是解题的关键,然后用极端转化的方法分析判断即可解题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
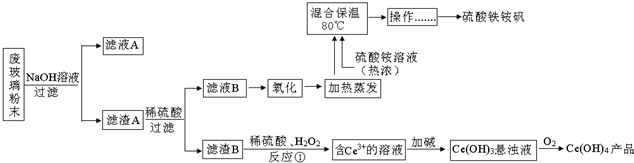

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
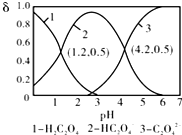
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大 | |
| D. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
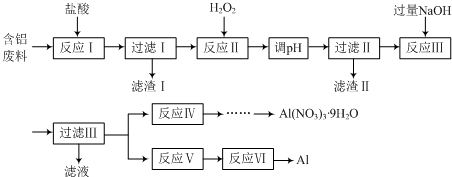
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
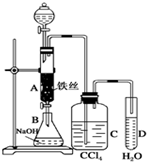 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
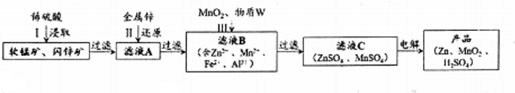
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com