
| ①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
 H++ SO42– (2分) (2)0.11 mol·L–1(2分)
H++ SO42– (2分) (2)0.11 mol·L–1(2分)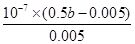 或(b-0.01)×10-5(2分)
或(b-0.01)×10-5(2分) H++ SO42–。
H++ SO42–。 H++ SO42–
H++ SO42– HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。
HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。 CH3COO- + H+
CH3COO- + H+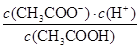 =
=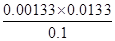 =1.77×10–5
=1.77×10–5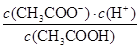 =
=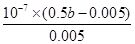 =(b-0.01)×10-5
=(b-0.01)×10-5

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.K+、[Al(OH)4]-、NO3-、Ba2+ | B.Na+、NH4+、Cl-、OH- |
| C.K+、Mg2+、SO42-、CO32- | D.H+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol·L-1的NaOH溶液:K+、Na+、SO42-、CO32- |
| B.与铝反应产生大量氢气的溶液:Na+、K+、Cl-、NO3- |
| C.0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、SCN- |
| D.使紫色石蕊试液变红的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.向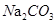 溶液通入 溶液通入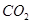 ,可使水解平衡: ,可使水解平衡: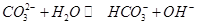 向正反应方向移动,则溶液pH增大 向正反应方向移动,则溶液pH增大 |
B.室温时,0.1mol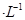 某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 |
C.25℃时,pH=13的1.0 L Ba 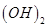 溶液中含有的 溶液中含有的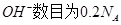 |
| D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.无色的溶液中:Fe3+、K+、NO3-、Cl- |
| B.pH=13的溶液中:NH4+、Na+、SO42-、Cl- |
| C.含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、H+ |
| D.c(H+)=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42- |
| C.能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
| D.c(Al3+)="0.5" mol·L-1的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=0的溶液中:K+、Fe2+、C1-、NO3- |
| B.强碱性溶液中:Na+、K+、A1O2-、CO32- |
| C.c(H+)=c(OH-)的溶液中:Na+、Ba2+、C1-、SO42- |
| D.使蓝色石蕊试液变红的溶液中:Na+、K+、SO32-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com