
已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O=10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
A.反应Ⅰ中HCl是氧化剂
B.反应Ⅱ中Cl2发生氧化反应
C.还原性:CoCl2>HCl>I2
D.氧化性:Co2O3>Cl2>HIO3
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:填空题
(1)2 mol O3与3 mol O2的质量之比 ,分子数之比 ,同温同压下的密度之比 ,含氧原子数之比 ,体积之比 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与 L Cl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为 ,推断的依据为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:填空题
某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32-、SiO32-、AlO2-、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示。
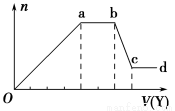
(1)若Y是盐酸,则Oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,
ab段发生反应的离子是 ,bc段发生反应的离子方程式为 。
(2)若Y是NaOH溶液,则X中一定含有的离子是 ,ab段反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-1钠、镁及其化合物练习卷(解析版) 题型:选择题
下列事实及其解释不正确的是 ( )。
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:选择题
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2、②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是 ( )。
A.I2在反应①中是还原产物,在反应②中是氧化产物
B.两个反应中生成等量的I2时转移的电子数相等
C.NaI和NaIO3在一定条件下能反应生成I2
D.NaIO3在化学反应中只能作氧化剂不能作还原剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:填空题
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 ,有关的离子方程式为 。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有 ,有关的离子方程式为 。
(4)原溶液可能大量存在的阴离子是下列的 。
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:选择题
下列说法中正确的是 ( )。
A.氯化钠在电流的作用下电离出Na+和Cl-
B.CaCO3难溶于水,但CaCO3属于强电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
D.硫酸钠在水中的电离方程式可表示为Na2SO4=2Na++S6++4O2-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
在溶液的配制过程中会引起浓度偏高的是 ( )。
①用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④向80 mL水中加入18.4 mol·L-1硫酸20 mL,配制3.68 mol·L-1的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水
A.①③⑤ B.②④⑤ C.③④ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:填空题
已知:H2A的A2-可表示S2-、SO42—、SO32—、SiO32—或CO32—。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
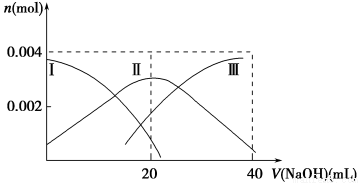
①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入_______________________________________________________。
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1 011.0 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
则反应③Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH3=________ kJ·mol-1。工业上制备Na2S时往往还要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热,维持反应③所需温度;其二是________________________________________。
(3)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com