

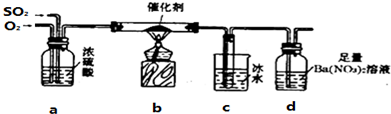

分析 (1)①关闭分液漏斗活塞,用导管连接出口插入水槽中,利用气体热胀冷缩进行检验;
②碘具有强氧化性,可以验证二氧化硫的还原性,二氧化硫与硫化氢反应生成S,反应中二氧化硫表现氧化③利用品红溶液检验二氧化硫的漂白性;
④碘具有强氧化性,在溶液中将二氧化硫氧化为硫酸,自身还有得到HI;
(2)①氧气的速率过快不利用二氧化硫转化;
②c中得到三氧化硫,d中白色沉淀为硫酸钡,根据硫元素守恒可得二氧化硫总质量,进而计算二氧化硫的转化率,反应结束后装置中残留二氧化硫及三氧化硫,需要排尽装置中二氧化硫及三氧化硫;
③根据②中测量原理进行计算;
(3)碱石灰可以吸收空气中二氧化碳、水蒸气,影响二氧化硫的含量测定,利用KMnO4溶液测定,当溶液刚褪色时,测定通入空气的体积V,根据高锰酸钾计算二氧化硫的量,进而计算空气中二氧化硫的含量.
解答 解:(1)①检查装置A的气密性:关闭分液漏斗活塞,用导管连接出口插入水槽中,用手捂住锥形瓶加热,若出气泡冒出,冷却后有一段液柱,则证明气密性良好,
故答案为:关闭分液漏斗活塞,用导管连接出口插入水槽中,用手捂住锥形瓶加热,若出气泡冒出,冷却后有一段液柱,则证明气密性良好;
②碘具有强氧化性,可以验证二氧化硫的还原性,二氧化硫与硫化氢反应生成S,反应中二氧化硫表现氧化性,D中出现浅黄色沉淀或浑浊,
故答案为:D中出现浅黄色沉淀或浑浊;
③B中盛放品红溶液,检验二氧化硫的漂白性,
故答案为:品红溶液;
④碘具有强氧化性,在溶液中将二氧化硫氧化为硫酸,自身还有得到HI,反应离子方程式为:I2+SO2+2H2O=2I-+4H++2SO42-,
故答案为:I2+SO2+2H2O=2I-+4H++2SO42-;
(2)①氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是:提高二氧化硫的转化率,
故答案为:提高二氧化硫的转化率;
②c中得到三氧化硫,d中白色沉淀为硫酸钡,根据硫元素守恒可得二氧化硫总质量,进而计算二氧化硫的转化率,反应结束后装置中残留二氧化硫及三氧化硫,需要排尽装置中二氧化硫及三氧化硫,
故答案为:排尽装置中二氧化硫及三氧化硫,使三氧化硫在C中成分冷却,二氧化硫被D充分吸收;
③生成三氧化硫为m g,生成硫酸钡为n g,根据硫原子守恒,则转化为二氧化硫为$\frac{m}{80}$mol,二氧化硫总物质的量为($\frac{m}{80}$+$\frac{n}{233}$)mol,故二氧化硫的转化率为:[$\frac{m}{80}$mol÷($\frac{m}{80}$+$\frac{n}{233}$)mol]×100%=[$\frac{m}{80}$÷($\frac{m}{80}$+$\frac{n}{233}$)]×100%,
故答案为:[$\frac{m}{80}$÷($\frac{m}{80}$+$\frac{n}{233}$)]×100%;
根据②中测量原理进行计算;
(3)碱石灰可以吸收空气中二氧化碳、水蒸气,影响二氧化硫的含量测定,利用KMnO4溶液测定,当溶液刚褪色时,测定通入空气的体积V,根据高锰酸钾计算二氧化硫的量,进而计算空气中二氧化硫的含量,
故答案为:a;当溶液刚褪色时,测定通入空气的体积V.
点评 本题考查物质性质探究实验、物质含量测定等,侧重考查学生对原理的理解,熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 元素的原子结构决定了元素在周期表中的位置 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在过渡元素中寻找半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的单质一定能将Y从NaY的水溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
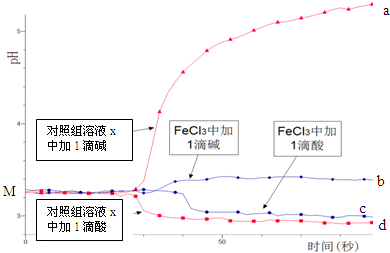
| A. | 依据M点对应的pH,说明Fe3+发生了水解反应 | |
| B. | 对照组溶液x的组成可能是0.003 mol/L KCl | |
| C. | 依据曲线c和d说明Fe3+水解平衡发生了移动 | |
| D. | 通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
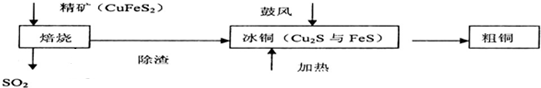
| A. | 焙烧时硫元素全部转化为二氧化硫 | B. | 在焙烧时氧化剂只有氧气 | ||
| C. | 粗铜精炼时用粗铜做阴极 | D. | Cu2S可用于火法炼制铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:MgO>CaS | B. | 熔点:Li>Na | ||
| C. | 沸点:SiCl4>CF4 | D. | 沸点:邻硝基苯酚>间硝基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
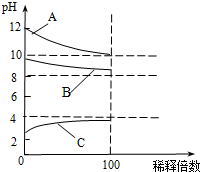 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com