
【题目】根据所学知识回答下列问题。
(1)已知Ksp(BaCO3) =2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①BaCO3在20 mL 0.01 mol·L-1Na2CO3溶液中的Ksp _________(填“大于”、“小于”或“等于”)其在20 mL 0.01 mol·L-1 BaCl2溶液中的Ksp
②现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______mol/L。
③向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中c(CO32—)/c(SO42—)=___________(保留三位有效数字)。
(2)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是_______________。(填写序号);b中氯离子的浓度为__________mol/L。
【答案】等于 5.2×10-5 23.6 b>a>d>c 9×10-10
【解析】
(1)①沉淀的溶度积常数在一定温度下是一个常数,所以BaCO3在20 mL 0.01 mol·L-1Na2CO3溶液中的Ksp等于其在20 mL 0.01 mol·L-1 BaCl2溶液中的Ksp,故答案为:等于;
②设BaCl2溶液的最小浓度为x mol·L-1,Na2CO3溶液的浓度为2×10-4mol·L-1,将等体积的Na2CO3溶液与BaCl2溶液混合,则混合液中c(CO32-)=1×10-4mol·L-1,c(Ba2+)=x/2 mol·L-1。根据溶度积规则知若要生成BaCO3沉淀则有Qc=(Ba2+)·c(CO32-)>Ksp(BaCO3),即1×10-4·x/2>2.6×10-9,则x>5.2×10-5 mol·L-1,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为5.2×10-5 mol·L-1。故答案为:5.2×10-5;
③当有BaCO3沉淀生成时,(Ba2+)·c(CO32-)=Ksp(BaCO3),则有:![]() =
=![]() =
=![]() ;故答案为:23.6;
;故答案为:23.6;
(2)a.现将足量氯化银放入100mL蒸馏水中,由溶解度常数可得溶液中的c(Ag+)=![]() mol/L;
mol/L;
b.100mL 0.2molL-1AgNO3溶液中Ag+浓度为0.2mol/L;
c. 100mL 0.1molL-1氯化铝溶液中氯离子浓度为0.3mol/L,c(Ag+)=1.8×10-10mol/L÷0.3mol/L=6×10-10mol/L;
d. 100mL 0.1molL-1盐酸溶液中氯离子浓度为0.1mol/L,c(Ag+)=1.8×10-10mol/L÷0.1mol/L=1.8×10-9mol/L;
综上所述大小顺序为b>a>d>c;在100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,加入氯化银后,氯离子浓度为![]() =9×10-10mol/L,故答案为:b>a>d>c;9×10-10。
=9×10-10mol/L,故答案为:b>a>d>c;9×10-10。


科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素。![]()
请回答下列问题:
(1)T的离子结构示意图为______________;
(2)元素的非金属性为:Q_____________R(填“强于”或“弱于”);
(3)R元素的氢化物的电子式为________________;
(4)T的单质与同周期金属性最强元素最高价氧化物对应的水化物反应的离子方程式为______________________________________;
(5)T的单质与W的最高价氧化物的水化物浓溶液共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味。你猜想该气体是_________(填化学式),请你设计一个简单的实验方案证明你的猜想___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时AgCl的Ksp=2×10-10;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
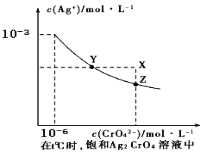
A. 在t℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D. 在t℃时,AgCl的溶解度大于Ag2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )

A. ①浊液中存在平衡:AgSCN(s)Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有SCN-
C. 该实验可以证明AgI比AgSCN更难溶
D. ③中颜色变化说明有AgI生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是
A.NH4+、K+、OH-、NO3-B.Mg2+、Na+、Cl-、SO42-
C.K+、H+、Cl-、HCO3-D.Fe2+、Ca2+、I-、CO 32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正在研发的锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如图。下列有关该电池的说法正确的是
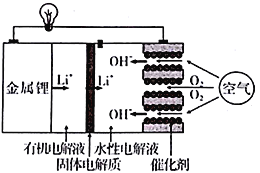
A. 有机电解液可以换成水性电解液
B. 放电时,外电路通过2 mol 电子,消耗氧气11.2 L
C. 放电和充电时,Li+迁移方向相同
D. 电池充电时,在正极上发生的反应为4OH--4e-= O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH 溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
(1)常温下,在 pH = 5 的稀醋酸溶液中,c(CH3COO-)=_____(不必化简)。下列方法中,可以使 0.10 mol·L-1 CH3COOH 的电离程度增大的是_____
a.加入少量 0.10 mol·L-1 的稀盐酸 b.加热 CH3COOH 溶液
c.加水稀释至 0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量 0.10 mol·L-1 的 NaOH 溶液
(2)将等质量的锌投入等体积且 pH 均等于 3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_____V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。(填写“>”、“<”或“=”)
(3)已知:90℃时,水的离子积常数为 Kw=3.8×10-13,在此温度下,将 pH=3 的盐酸和 pH=11 的氢氧化钠溶液等体积混合,则混合溶液中的 c(H+)=_____mol/L(保留三位有效数字)。
Ⅱ.(1)常温下,已知 0.1 mol·L-1 一元酸HA 溶液中c(OH-)/c(H+)=1×10-8。常温下,0.1mol·L-1 HA溶液的 pH=_____;
(2)常温下,向 pH=a 的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的 pH_____(14-a)(填写“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com