
| 编号 | 实 验 操 作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置 于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 将CO2通入Na2SiO3水溶液观察是否有沉淀产生 | 探究碳和硅两元素非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫为酸性氧化物;
B.铁离子浓度增大,向生成络合离子的方向移动;
C.2NO2?N2O4的平衡移动受温度影响,且二氧化氮为红棕色气体;
D.CO2通入Na2SiO3水溶液中发生强酸制取弱酸的反应.
解答 解:A.二氧化硫为酸性氧化物,SO2气体通入紫色石蕊试液中,溶液变红,与漂白无关,故A错误;
B.铁离子浓度增大,向生成络合离子的方向移动,则增大反应物浓度时平衡正向移动,故B正确;
C.2NO2?N2O4的平衡移动受温度影响,且二氧化氮为红棕色气体,则改变温度可探究温度对化学平衡的影响,故C正确;
D.CO2通入Na2SiO3水溶液中发生强酸制取弱酸的反应,可知碳酸的酸性大于硅酸的酸性,则可探究碳和硅两元素非金属性强弱,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、平衡移动、非金属性比较为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
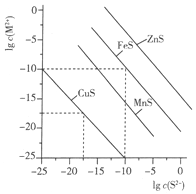 一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )| A. | 该温度下,Ksp(MnS)大于1.0×10-35 | |
| B. | 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀 | |
| C. | 向c(Fe2+)=0.1mol•L-1的溶液中加入CuS粉末,有FeS沉淀析出 | |
| D. | 该温度下,溶解度:CuS>MnS>FeS>ZnS |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
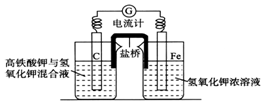 高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中.如图甲是高铁电池的实验装置:已知放电后,两极得到铁的相同价态的化合物.
高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中.如图甲是高铁电池的实验装置:已知放电后,两极得到铁的相同价态的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙 述Ⅰ | 叙 述Ⅱ |
| A | NH3溶于水显碱性 | 用氨气作“喷泉实验” |
| B | 高锰酸钾具有强氧化性 | 高锰酸钾须与活性金属粉末分开储存 |
| C | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| D | 碘在酒精中溶解度大于在水中溶解度 | 用酒精萃取碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
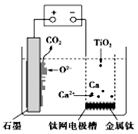 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是| A. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| B. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| C. | 若用铅蓄电池作供电电源,“一”接线柱应连接Pb电极 | |
| D. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
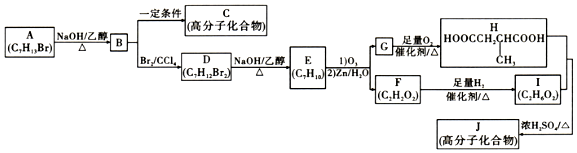
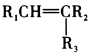 $→_{(2)Zn/H_{2}O}^{(1)O_{3}}$
$→_{(2)Zn/H_{2}O}^{(1)O_{3}}$
 .
. +(2n-1)H2O.
+(2n-1)H2O. .
. →
→ 的流程.(无机试剂及溶剂任选)
的流程.(无机试剂及溶剂任选)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com