
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,反应原理如下图所示。下列说法错误的是
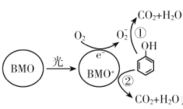
A.苯酚被氧化的总反应:C6H5OH+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.反应过程中BMO表现较强氧化性
C.在酸性条件下,反应①的离子方程式是3C6H5OH+28![]() +28H+=l8CO2↑+23H2O
+28H+=l8CO2↑+23H2O
D.过程①和②中被降解的苯酚的物质的量之比为1:3
【答案】BD
【解析】
通过分析原理图可知,在光催化降解苯酚的过程中:BMO首先在光照下,发生失电子的氧化反应,转化成BMO+,同时将O2还原为![]() ;随后,BMO+和
;随后,BMO+和![]() 各自表现氧化性将苯酚转化为H2O和CO2,这个过程BMO+又被还原为最初的状态。
各自表现氧化性将苯酚转化为H2O和CO2,这个过程BMO+又被还原为最初的状态。
A.根据分析可知,该过程中苯酚在光照、BMO作催化剂的条件下被氧气氧化生成CO2和H2O,反应方程式为C6H5OH+7O2![]() 6CO2+3H2O,A选项正确;
6CO2+3H2O,A选项正确;
B.通过分析可知,BMO在光催化降解苯酚过程中表现出了还原性,生成了BMO+,B选项错误;
C.酸性条件下,反应①中苯酚、![]() 与H+反应生成CO2和H2O,反应的离子方程式是3C6H5OH+28
与H+反应生成CO2和H2O,反应的离子方程式是3C6H5OH+28![]() +28H+=18CO2↑+23H2O,C选项正确;
+28H+=18CO2↑+23H2O,C选项正确;
D.1个BMO+表现氧化性,被还原为BMO,可以得1个电子;1个![]() 表现氧化性,被还原为2个H2O,可以得3个电子,所以①和②中被降解的苯酚的物质的量之比为3:1,D选项错误;
表现氧化性,被还原为2个H2O,可以得3个电子,所以①和②中被降解的苯酚的物质的量之比为3:1,D选项错误;
答案选BD。


科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)25℃时,水的电离平衡曲线应为_________请说明理由_________
(2)95℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为_________
(3)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)已知:H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1
SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
则硫化氢气体分解为氢气和固体硫的热化学方程式为___。
(2)K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
(已知:H2CO3lgK1=-6.4,lgK2=-10.3;H2SlgKl=-7.0,lgK2=-19.0)。
(3)工业上采用图1所示装置电解K4[Fe(CN)6]和KHCO3混合溶液一段时间,然后停止电解,通入H2S,利用生成的K3[Fe(CN)6]将H2S转化为S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___。
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() 。通H2S发生反应的离子反应方程式为___。
。通H2S发生反应的离子反应方程式为___。

(4)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图2所示。t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是___。

(5)H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图3所示,H2S的电离平衡常数Ka1=___。写出pH由12.0变为16.0时发生的主要的离子方程式:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.17g-OH中含有的电子数为10NA
B.25°C时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C.1L1molL-1CH3COONH4溶液中CH3COO-与NH4+数目均为NA
D.含0.5mol晶胞(下图)的Cu2O晶体中Cu2+的数目为2NA

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为“国防金属”的镁 ,60%来自海洋,从海水中提取镁的正确方法是( )

A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)当前,产量最高,用途最广的金属是_____________。
(2)这三种金属的金属活动性由强到弱的顺序是_______________ 。
(3)硫酸铁有净水的作用。写出硫酸铁的电离方程式:_____________ 。
(4)小块金属钠投入水中,发生反应的化学方程式为_____________;可观察到的实验现象是_____(填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动d.水变红色
(5)足量的铝与氢氧化钠溶液反应后得到标准状况下的氢气2.24L,则参加反应的铝的质量为_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属(碳、硅、氯、硫、氮等)及其化合物,是构成自然界的重要物质,在人类的生产和生活中有广泛的应用。
(1)a.碳酸钠、b.氯气、c.氢氧化钠、d.二氧化硅、e.盐酸5种物质中:
①属于盐的是___(填序号);
②水晶的主要成分是___;
③水溶液具有漂白性的是___;
(2)碳酸钠溶于水发生电离,其电离方程式为___。
(3)硅酸钠的水溶液俗称水玻璃,向水玻璃中滴加盐酸立刻生成一种凝胶,写出该凝胶的化学式____。
(4)某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为___(用化学方程式表示)。
(5)向H2S 饱和溶液中通入氯气,马上出现了淡黄色浑浊,溶液酸性明显增强,请写出该反应的化学方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com