
| A. | K+HCO3-NO3-ClO- | B. | Na+SO32-NH4+Ba2+ | ||
| C. | Ba2+ HS-Cl-SO42- | D. | AlO2-CO32-Cl-Na+ |
分析 强碱性溶液中存在大量氢氧根离子,
A.碳酸氢根离子与氢氧根离子反应;
B.钡离子与亚硫酸根离子反应生成亚硫酸钡沉淀,铵根离子与强碱性溶液中的氢氧根离子反应;
C.钡离子与硫酸根离子反应生成硫酸钡沉淀,硫氢根离子与氢氧根离子反应;
D.四种离子之间不发生反应,都不与氢氧根离子反应.
解答 解:A.HCO3-与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.SO32-、Ba2+之间反应生成沉淀,NH4+与强碱性溶液反应,在溶液中不能大量共存,故B错误;
C.Ba2+、SO42-之间反应生成硫酸钡沉淀,HS-与强碱性溶液反应,在溶液中不能大量共存,故C错误;
D.Al2-、CO32-、Cl-、Na+之间不发生反应,都不与强碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 吸热反应需要加热后才能发生 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素与非金属元素间只能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物? | |
| C. | 离子化合物中可能有共价键? | |
| D. | 共价化合物中可能有离子键? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
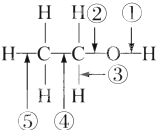
| A. | 和金属钠反应时①键断裂 | |
| B. | 在铜催化及加热条件下与O2反应时断裂①键和③键 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
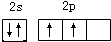 ;
;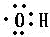 .
.| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| Ⅱ | 387 | 0.80 | a | |
| Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是气态 | |
| B. | R一定是离子化合物 | |
| C. | R一定是共价化合物 | |
| D. | R可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚中滴加少量的稀溴水出现了1-溴苯酚的白色沉淀 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com