
| A.同一原子中,2p,3p,4p能级的轨道依次增多 |
B.当碳原子的核外电子排布由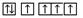 转变为 转变为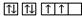 时,这一过程中释放能量 时,这一过程中释放能量 |
| C.3p2表示3p能级有两个轨道 |
| D.在同一能级上运动的电子,其运动状态可能相同 |
科目:高中化学 来源:不详 题型:填空题
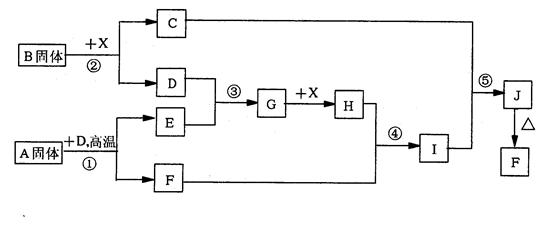
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2SO4>HClO4>HBrO4 | B.半径:Li+<Mg2+<Al3+<O2- |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱金属元素中,金属活泼性最强的是Li |
| B.第三周期元素中,原子半径最大的是Cl |
| C.短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4 |
| D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.52 | B.28 | C.24 | D.76 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com