
| A. | 向溶液中加入少许KCl固体,溶液颜色变浅 | |
| B. | 升高温度,平衡一定发生移动 | |
| C. | 加入少许KCl固体或者加入少许FeCl3固体平衡常数均发生变化,且变化方向相反 | |
| D. | 平衡常数表达式为K=$\frac{c[Fe(SCN)_{3}]•{c}^{3}(KCl)}{c(FeC{l}_{3})•{c}^{3}(KSCN)}$ |
分析 A.根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
B.反应一定存在热效应,升高温度平衡一定发生移动;
C.平衡只受温度影响;
D.应用实际参加反应的物质或离子表示平衡常数.
解答 解:A.根据实际参加反应的离子浓度分析,化学平衡为Fe3++3SCN-=Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,溶液颜色不变,故A错误;
B.反应一定存在热效应,升高温度平衡一定发生移动,故B正确;
C.平衡只受温度影响,浓度不影响平衡常数,故C错误;
D.FeCl3+3KSCN?Fe(SCN)3+3KCl的离子方程式为Fe3++3SCN-=Fe(SCN)3,平衡常数表达式K=$\frac{c[Fe(SCN)_{3}]}{c(F{e}^{3+})×{c}^{3}(SC{N}^{-})}$,故D错误,
故选:B.
点评 本题考查化学平衡的影响因素,注意根据实际参加反应的物质或微粒进行分析解答,难度中等.


科目:高中化学 来源: 题型:解答题
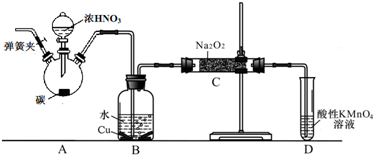
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
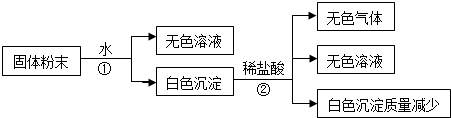
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为5:1 | |
| C. | 每生成1mol的NaClO3转移6mol的电子 | |
| D. | Cl2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中只存在共价键,一定不含有离子键 | |
| C. | 金属晶体的熔沸点均很高 | |
| D. | 分子晶体中一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L1.2mol•L-1的Na2SO4溶液 | B. | 2L 0.8mol•L-1的Na0H溶液 | ||
| C. | 1L1mol•L-1的Na2CO3溶液 | D. | 4L 0.5mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L由H2和O2组成的混合气体,所含分子总数为NA | |
| B. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| C. | 常温常压下,1 mol氖气含有的原子数为NA | |
| D. | 1L1 mol.L-l FeCl3溶液中Fe3+的数目小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com