
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、0℃、1个标准大气压下,22.4 L NO 和22.4 L O2混合后,所得气体中的分子总数为1.5NA |
| C、1.8 g重水(D2O)中含有的质子数和电子数均为1.0NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
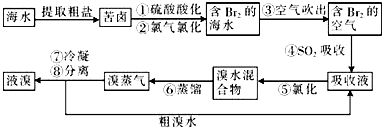
查看答案和解析>>
科目:高中化学 来源: 题型:
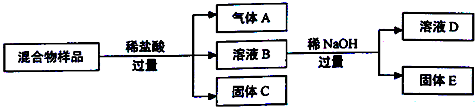
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MgCl2(熔融)
| ||||
B、2AlCl3(熔融)
| ||||
C、HgO+CO
| ||||
D、2MgO+C
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com