
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu) 中各成分的质量分数。取两份质量均为mg的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1mL和V2 mL(已折算到标准状况下)。
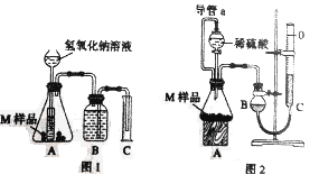
(1)写出实验1中可能发生反应的离子方程式:________________________;
(2)M样品中铜的质量的数学表达式为(用V1和V2表示):_________________________。
(3)实验1进行实验前,B瓶中水没有装满,使测得气体体积________________________。(填“偏大”、“偏小”或“无影响”,下同);若拆去实验2中导管a,使测得气体体积___________________。
(4)该实验需要0.50 mol·L-1的NaOH溶液470mL,配制时应用托盘天平称量______________gNaOH 。
(5)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3) 配制的,欲用该浓硫酸配制成浓度为0.5 mol/L的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需______________、______________、______________。
②所取浓硫酸的体积为_________mL。
下列操作引起所配溶液浓度偏高的是________________
A.取浓硫酸时俯视 B.在烧杯中稀释浓硫酸后,立即转移
C.定容时俯视 D.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
【答案】 2Al+2OH-+2H2O=2AlO2-+3H2↑ m(Cu)=m g-![]() mol×27 g·mol-1-
mol×27 g·mol-1-![]() mol×56 g·mol-1=m g-
mol×56 g·mol-1=m g-![]() g 无影响 偏大 10.0 量筒 100mL容量瓶 胶头滴管 2.7 BC
g 无影响 偏大 10.0 量筒 100mL容量瓶 胶头滴管 2.7 BC
【解析】试题分析:本题考查质量分数的测定实验、溶液的配制和误差分析,涉及Fe、Al和Cu的性质、离子方程式的书写、实验的误差分析和计算。
(1)实验1在样品中滴加NaOH溶液,样品中只有Al能与NaOH溶液反应,Al与NaOH溶液反应生成NaAlO2和H2,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)实验1中只有Al与NaOH溶液反应产生H2,根据关系式2Al~3H2↑,n(Al)=![]() mol=
mol=![]() mol,m(Al)=n(Al)
mol,m(Al)=n(Al)![]() 27g/mol=
27g/mol=![]() mol
mol![]() 27g/mol;实验2中Al和Fe都与稀硫酸反应放出H2,反应的化学方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑、Fe+H2SO4=FeSO4+H2↑,由于两份样品的质量相等,则其中Al与NaOH溶液、稀硫酸反应放出的H2相等,Fe与稀硫酸反应放出的H2的体积为(V2-V1)mL,根据关系式Fe~H2↑,n(Fe)=
27g/mol;实验2中Al和Fe都与稀硫酸反应放出H2,反应的化学方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑、Fe+H2SO4=FeSO4+H2↑,由于两份样品的质量相等,则其中Al与NaOH溶液、稀硫酸反应放出的H2相等,Fe与稀硫酸反应放出的H2的体积为(V2-V1)mL,根据关系式Fe~H2↑,n(Fe)=![]() mol,m(Fe)=n(Fe)
mol,m(Fe)=n(Fe)![]() 56g/mol=
56g/mol=![]() mol
mol![]() 56g/mol;M样品中m(Cu)=mg-m(Al)-m(Fe)=mg-
56g/mol;M样品中m(Cu)=mg-m(Al)-m(Fe)=mg-![]() mol
mol![]() 27g/mol-
27g/mol-![]() mol
mol![]() 56g/mol=mg-
56g/mol=mg-![]() g。
g。
(3)实验1进行实验前,B瓶中水没有装满,对测得气体体积无影响,因为B瓶中收集的气体的体积等于排入C中水的体积。若拆去实验2中导管a,由于稀硫酸滴入锥形瓶中会排出装置中的空气,使测得气体的体积偏大。
(4)配制470mLNaOH溶液应选用500mL容量瓶,用托盘天平称量NaOH的质量为m(NaOH)=0.5mol/L![]() 0.5L
0.5L![]() 40g/mol=10.0g。
40g/mol=10.0g。
(5)①由浓溶液配制稀溶液的实验步骤为:计算、量取、稀释、冷却、转移、洗涤、初步振荡、定容、摇匀、装瓶贴标签,所需仪器除烧杯、玻璃棒外还需量筒、100mL容量瓶、胶头滴管。
②根据稀释前后H2SO4物质的量不变,1.84g/cm3V(浓H2SO4)![]() 98%
98%![]() 98g/mol=0.5mol/L
98g/mol=0.5mol/L![]() 0.1L,V(浓H2SO4)=2.7mL。
0.1L,V(浓H2SO4)=2.7mL。
A,取浓硫酸时俯视,所量取浓硫酸的体积偏小,硫酸物质的量偏小,所配溶液物质的量浓度偏低;B,在烧杯中稀释浓硫酸后,立即转移,浓硫酸溶于水放热,冷却后所配溶液体积偏小,所配溶液物质的量浓度偏高;C,定容时俯视,所配溶液体积偏小,所配溶液物质的量浓度偏高;D,颠倒摇匀后发现液面低于刻度线,但未加水至刻度线,对所配溶液物质的量浓度无影响;引起所配溶液浓度偏高的是BC,答案选BC。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是( )
A.用电解法精炼粗铜时,粗铜作阳极
B.在原电池中,铜电极只能作正极
C.在镀件上镀铜时,金属铜作阳极
D.锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl﹣)
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)═2c(HCO3﹣)+2c(H2CO3)+2c(CO ![]() )
)
D.pH=1的NaHSO4溶液:c(H+)═2c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体如图所示与所述情形相符的是( )

A. 向HCl和AlCl3的混合液中滴加NaOH
B.向NaOH和Ca(OH)2的混合液中通入CO2
C.向NH4Al(SO4)2溶液中滴加NaOH
D.向NaOH和Na2CO3的混合液中滴加稀HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含b mol硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A.0.1(b﹣2a) molL﹣1
B.10(2a﹣b) molL﹣1
C.10(b﹣a) molL﹣1
D.10(b﹣2a) molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A-J间的转化关系如图所示,A、C为金属氧化物,其中A 为红棕色粉末,B、D是生活中常见金属单质,F、J是难溶于水的白色化合物,G、J受热后容易分解。
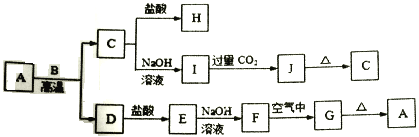
(1)A 的化学式是________________;
(2)I→J 反应的离子方程式是_______________________________;
(3)F转化为G的过程中观察到的现象是__________________________,反应的化学方程式是___________________________;
(4)检验E 中主要阳离子的方法________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. ω=17c/(1 000ρ)
C. ω=17V/(17V+22 400)
D. c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子[M(CN)n]m-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
终点时,溶液由黄色变成橙红色。Ag++2CN-=[Ag(CN)2]-
根据以上知识回答下列问题:
(1)水样预处理的目的是。
(2)水样预处理的装置如图,细导管插入吸收液中是为了。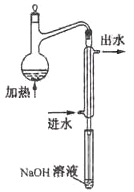
(3)蒸馏瓶比吸收液面要高出很多,其目的是。
(4)如果用盐酸代替磷酸进行预处理,实验结果将(填“偏高”、“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.010 00 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为mg·L-1(以CN-计,计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用右图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
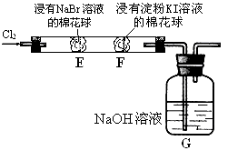
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+ 2Br-=2Cl-+ Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH- + Cl2 = ClO-+ Cl-+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com