
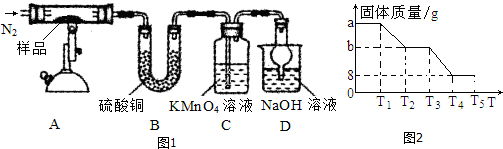
分析 SO2气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,从而导致雨水的酸性增强,据此解答.
解答 解:(1)SO2溶于雨水生成H2SO3,H2SO3可被空气中O2缓慢氧化成H2SO4,反应的化学方程式为:SO2+H2O?H2SO3 2H2SO3+O2=2H2SO4 ,
故答案为:SO2+H2O?H2SO3 2H2SO3+O2=2H2SO4;
(2)酸雨形成是SO2溶于雨水生成H2SO3,H2SO3可被空气中O2缓慢氧化成H2SO4,反应的化学方程式为:SO2+H2O?H2SO3 2H2SO3+O2=2H2SO4 ,由于H2SO3是较弱的而H2SO4是强酸,所以随着酸雨中H2SO3逐渐氧化成H2SO4,酸雨的酸性逐渐增强,pH逐渐减小,直到H2SO3全部被氧化成H2SO4后pH不再改变,
故答案为:由于H2SO3是较弱的而H2SO4是强酸,所以随着酸雨中H2SO3逐渐氧化成H2SO4,酸雨的酸性逐渐增强,pH逐渐减小,直到H2SO3全部被氧化成H2SO4后pH不再改变.
点评 本题考查了二氧化硫的污染、酸雨的形成及危害,明确二氧化硫的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度时水溶液碱性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3>Na2CO3 | |
| C. | 与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子晶体 | 原子晶体 | 分子晶体 |
| A | NaOH | Ar | SO2 |
| B | K2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | 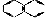 |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 硫离子的结构示意图: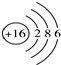 | |
| C. | H2O2的结构式:H-O-H-O | |
| D. | NH4I的电子式: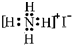 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制皂 | |
| B. | 安全、合理的使用核能有利于降低碳排放 | |
| C. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| D. | 吸烟不会造成室内PM 2.5污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com