
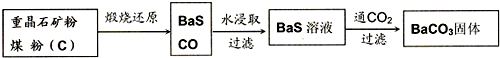
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温锻烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:

(1)若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为______。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持及应所需的高温,应采取的措施是______。
a.加人过量的炭,同时通入空气 b.设法将生成的BaS及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是______。
(4)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4 (s)+CO32-(aq)  BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
则:①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为______。
②与高温煅烧还原法相比,沉淀转化法的优点主要有______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为______。如用1.00 L 0. 210 mol • L-1 Na2CO3溶液处理,试计算BaSO4被转化的质量______(要有计算过程,结果保留3位有效数字)。
(18分)
(1)BaSO4+4C BaS+4CO↑(3分)
BaS+4CO↑(3分)
(2)a(2分)
(3)H2SO4(2分,其它合理答案也给分)
(4)①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO4全部转化为BaCO3)(3分)
②节能、环保等(2分)
③5×10-2(2分)
解:设BaSO4被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:
BaSO4 (s)+CO32-(aq)  BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
起始浓度/mol•L-1 0.210 0
变化浓度/mol•L-1 x x
起始浓度/mol•L-1 0.210—x x (1分)
由于K= =
= ,则
,则 =
=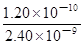 (1分)
(1分)
解得:x=0.0100(1分)
由于m=n•M,则BaSO4被转化的质量为0.0100mol×233g/mol=2.33g(1分)
答:BaSO4被转化的质量为2.33g。
【解析】
试题分析:(1)依题意,BaSO4与C在高温下发生氧化还原反应,生成BaS和CO,硫元素由+6降为—2价,碳元素由0升为+2价,根据化合价升降总数相等、原子个数守恒,则该反应为BaSO4+4C BaS+4CO↑;(2)加入过量的碳,同时通入空气,可以使C与氧气反应,该反应是放热反应,碳过量不仅能使硫酸钡充分还原,还能维持反应所需的高温,故a正确;硫化钡是固体,固体物质的浓度是常数,将生成的硫化钡及时移走,不能使平衡向正反应方向移动,故b错误;(3)硫化钡是强碱弱酸盐,能溶于水,且与水反应生成氢氧化钡和硫化氢气体,氢氧化钡是可溶性强碱,过量的碳或未完全反应的硫酸钡等难溶于水,过滤所得滤渣的主要成分是碳或硫酸钡等物质,滤渣能吸附可溶性的钡离子、氢氧根离子,钡离子遇硫酸产生白色的硫酸钡沉淀,因此取最后一次洗涤液少许于试管,滴入少量稀硫酸,若产生白色沉淀,说明沉淀未洗涤干净;反之,则洗涤干净;另外,选择酚酞等指示剂也可以检验是否含有氢氧根离子;(4)根据浓度对平衡移动的影响规律,增大碳酸根离子浓度,可以使沉淀平衡右移,则设计的实验方案为①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO4全部转化为BaCO3);②高温煅烧法需要消耗能量,产生有毒的硫化氢气体,步骤多,而沉淀转化法则节约能源,环保,操作步骤少等;③设BaSO4被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:
BaS+4CO↑;(2)加入过量的碳,同时通入空气,可以使C与氧气反应,该反应是放热反应,碳过量不仅能使硫酸钡充分还原,还能维持反应所需的高温,故a正确;硫化钡是固体,固体物质的浓度是常数,将生成的硫化钡及时移走,不能使平衡向正反应方向移动,故b错误;(3)硫化钡是强碱弱酸盐,能溶于水,且与水反应生成氢氧化钡和硫化氢气体,氢氧化钡是可溶性强碱,过量的碳或未完全反应的硫酸钡等难溶于水,过滤所得滤渣的主要成分是碳或硫酸钡等物质,滤渣能吸附可溶性的钡离子、氢氧根离子,钡离子遇硫酸产生白色的硫酸钡沉淀,因此取最后一次洗涤液少许于试管,滴入少量稀硫酸,若产生白色沉淀,说明沉淀未洗涤干净;反之,则洗涤干净;另外,选择酚酞等指示剂也可以检验是否含有氢氧根离子;(4)根据浓度对平衡移动的影响规律,增大碳酸根离子浓度,可以使沉淀平衡右移,则设计的实验方案为①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO4全部转化为BaCO3);②高温煅烧法需要消耗能量,产生有毒的硫化氢气体,步骤多,而沉淀转化法则节约能源,环保,操作步骤少等;③设BaSO4被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:
BaSO4 (s)+CO32-(aq)  BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
起始浓度/mol•L-1 0.210 0
变化浓度/mol•L-1 x x
起始浓度/mol•L-1 0.210—x x (1分)
由于K= =
= =
=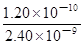 =5×10-2
=5×10-2
则 =
=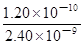 =5×10-2(1分)
=5×10-2(1分)
解得:x=0.0100(1分)
由于m=n•M,则BaSO4被转化的质量为0.0100mol×233g/mol=2.33g(1分)。
考点:考查有关物质制备的化学工艺流程,涉及关键环节化学方程式的书写、检验沉淀是否洗净、设计实验方案、根据溶度积求平衡常数和沉淀被转化的质量等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 煅烧还原 |
| 水浸取 |
| 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
|
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ??mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=—1473.2 kJ??mol-1
Ba(s)+S(s)=BaS(g) △H=—460 kJ??mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
![]()

已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)![]() 571.2 kJ?mol
571.2 kJ?mol![]()
Ba(s)+S(s)+2O2(g):BaSO4(s)![]() 1473.2 kJ?mol
1473.2 kJ?mol![]()
Ba(s)+S(s)=BaS(g)![]() 460 kJ?mol
460 kJ?mol![]()
请回答: .
(1)C(s)和O2(g)反应生成CO(g)的热化学方程式为 。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是 。
(3)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO![]() (aq)= BaCO3(s)+SO
(aq)= BaCO3(s)+SO![]() (aq)
(aq)
则:① 在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为 。
② 与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有 。
③ 已知:查看答案和解析>>
科目:高中化学 来源:安徽省合肥市2010届高三第一次教学质量检测 题型:填空题
|
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=—1473.2 kJ•mol-1
Ba(s)+S(s)=BaS(g) △H=—460 kJ•mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com