
| A、用NH3表示的化学反应速率为0.1 mol/(L?s) |
| B、维持容积的体积不变充入氩气,会加快该反应的速率 |
| C、增加H2的浓度该正反应速率和逆反应速率都会加快 |
| D、反应足够长时间,N2、H2中至少有一种物质浓度降为零 |
| △c |
| t |
| △c |
| t |
| 5mol/L-4mol/L |
| 10s |


科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B、该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 |
| C、若用18O原子组成的O2参加反应,平衡时SO2中也会含有18O |
| D、在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:
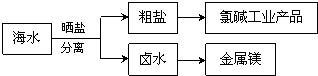
| A、通过氯碱工业可生产的产品有NaOH、NaClO、盐酸等 |
| B、卤水经过蒸发结晶可直接得到较纯净的MgCl2?6H2O晶体 |
| C、粗盐精制的过程只发生物理变化 |
| D、在高温下用氢气还原MgCl2可制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 |
| B、分子晶体中都存在共价键 |
| C、氯化氢和氯化钾的溶解克服相同类型作用力 |
| D、在晶体中只要有阴离子就一定有阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是( )
如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是( )| A、(4)>(2)>(1)>(3) |
| B、(2)>(1)>(3)>(4) |
| C、(4)>(2)>(3)>(1) |
| D、(3)>(2)>(4)>(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com