
| A. | 所有的盐溶液均呈中性 | |
| B. | 盐类的水解过程破坏了纯水的电离平衡 | |
| C. | 盐类的水解是酸碱中和反应的逆反应 | |
| D. | 升高温度可以促进盐类的水解 |
分析 A、易水解的盐溶液大多不是中性的;
B、盐类的水解过程是弱离子结合水电离出的氢离子或是氢氧根离子的过程;
C、盐类的水解是酸碱中和反应的逆反应;
D、盐的水解反应是吸热的过程.
解答 解:A、对于含有弱离子的盐,其溶液可以为中性,可以不是中性,故A错误;
B、盐类的水解过程是弱离子结合水电离出的氢离子或是氢氧根离子的过程,破坏了纯水的电离平衡,促进了水的电离,故B正确;
C、盐类的水解是酸碱中和反应的逆反应,故C正确;
D、盐的水解反应是吸热的过程,升高温度可以促进盐类的水解,故D正确.
故选A.
点评 本题考查了盐的水解原理及其影响因素,题目难度中等,注意掌握盐的水解原理及影响因素,明确盐的水解过程促进了水的电离,且能够水解的盐溶液不一定为酸性或碱性,有可能为中性,如醋酸铵溶液.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98 g | B. | 1mol O2的质量是32g | ||
| C. | 2g氢气所含原子数目为1 mol | D. | 22.4LCH4物质的量是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
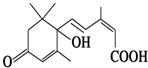 北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.
北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
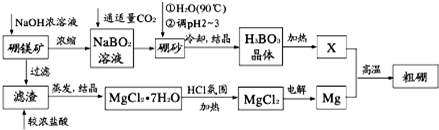
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2 | |
| C. | 向H2O中加入少量Na2O2,产生无色气体:2Na2O2+2H2O═O2↑+4OH-+4Na+ | |
| D. | 向Cl2水中滴入适量FeCl2 溶液,溶液变为黄色:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com