
| A. | 1molCH3+(甲基正离子)中含有电子数为10NA | |
| B. | 1mol-CH3(甲基)中含有电子数为10NA | |
| C. | 1mol-OH(羟基)与1molOH-所含有电子数相同,均为10NA | |
| D. | 1.8gNH4+中含有的电子数为NA |
分析 A、碳正离子中含有8个电子,1molCH3+(碳正离子)中含有8mol电子;
B、1mol-CH3(甲基)中含有9mol电子;
C、-OH(羟基)与OH-所含电子数分别是9、10;
D、1molNH4+中含有的电子10mol,据m=nM来计算即可.
解答 解:A、碳正离子中含有8个电子,1molCH3+(碳正离子)中含有8mol电子,含有电子数为8NA,故A错误;
B、1mol-CH3(甲基)中含有9mol电子,含有电子数为9NA,故B错误;
C、-OH(羟基)与OH-所含电子数分别是9、10,1mol-OH(羟基)与1molOH-所含有电子数不相同,分别为9NA、10NA,故C错误;
D、1molNH4+中含有的电子10mol,1.8g即0.1molNH4+中含有的电子数为NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题题量较大,知识点较多,充分考查了学生对所学知识的掌握情况,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:填空题
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作和现象 |
| A | 检验含Fe2+、Fe3+混合溶液中的Fe2+ | 向溶液中加入足量新制氯水,再加入少量KSCN溶液,溶液变红 |
| B | 检验木炭与浓硫酸反应会生成CO2 | 浓硫酸和木炭混合加热,将生成的气体通入足量澄清石灰水,澄清石灰水变浑浊 |
| C | 验证非金属性:Si<C<Cl | 向Na2CO3固体中加入过量盐酸,将产生的气体直接通入NaSiO3中,产生白色沉淀 |
| D | 验证Ksp[Cu(OH)2]<Ksp[Mg (OH)2] | 向NaOH溶液中滴加足量的MgCl2溶液,产生白色沉淀,在滴加足量的CuCl2溶液,沉淀变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、Fe2+、NO3- | B. | K+、NH4+、OH-、SO42- | ||
| C. | Na+、OH-、K+、HCO3- | D. | K+、H+、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、负极均可为惰性电极 | |
| B. | 正极的电极反应式均为O2+2H20+4e-=40H- | |
| C. | 正极通入的气体必须为纯氧气 | |
| D. | 1mol上述燃料完全放电,转移的电子数均为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
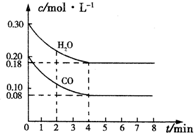 (1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,
(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,| t/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com