
| n |
| c |
| 0.25mol |
| 2mol/L |


科目:高中化学 来源: 题型:
| 时间 | 0min | 2min | 4min | 6min | 8min | 10min |
| Z的浓度mol/L | 0 | 0.8 | 1.2 | 1.4 | 1.4 | 1.4 |
| A、用Y来表示0-4min的平均反应速率为0.15mol/(L?min) |
| B、该温度下反应的化学平衡常数为18.15 |
| C、向平衡体系中再加入2molX和1mol Y,达到新的平衡时X的体积分数增大 |
| D、对平衡体系降低温度,化学反应后速率减慢,但Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
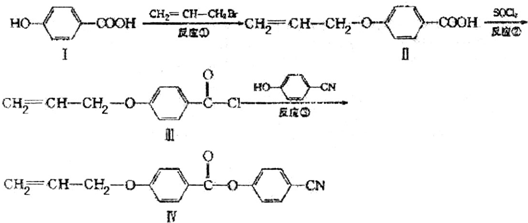
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X只能是第三周期元素 |
| B、a-b+n+m=10或16 |
| C、b不大于6 |
| D、Y不可能是第二周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
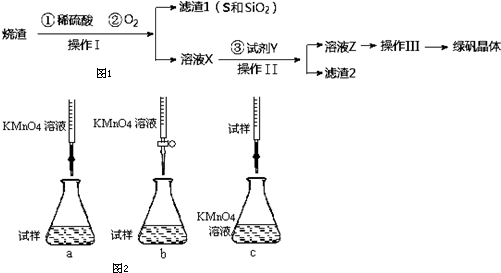
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
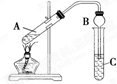 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.| 组 序 号 | 催化剂 | 反应现象 | C中饱和碳 酸钠溶液中 酯层高度 |
| ① | 2mL 98% 浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 | 2.10cm |
| ② | 2mL 14mol?L-1 硫酸 | 反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.14cm |
| ③ | 2mL 10mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.16cm |
| ④ | 2mL 7mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 | 2.00cm |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com