
将1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672ml气体(标准状况),将盛有此气体的容器倒扣在水中,通入少量氧气,最后剩余气体224ml(标准状况)。则通入的氧气在标准状况下的体积为
A.504ml B.168ml C.336ml D.224ml
B
【解析】
试题分析:672ml气体应该是NO2和NO的混合物,物质的量是0.672L÷22.4L/mol=0.03mol。通入氧气后剩余的气体一定是NO,物质的量是0.01mol。1.92g铜在反应中共失去 电子,则根据电子的得失守恒可知,消耗氧气的物质的量是
电子,则根据电子的得失守恒可知,消耗氧气的物质的量是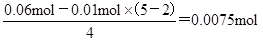 ,在标准状况下的体积是0.0075mol×22.4L/mol=0.168L=168ml,答案选B。
,在标准状况下的体积是0.0075mol×22.4L/mol=0.168L=168ml,答案选B。
考点:考查铜和硝酸反应的有关计算
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。试题基础性强,注重解题的灵活性,有利于培养学生的逻辑思维能力和创新思维能力。该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
| ||
| △ |
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ||
| △ |
| ||
| △ |
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
| ||
| △ |
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应。向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。
![]()
![]() 乙组: Cu CuO CuSO4
乙组: Cu CuO CuSO4
![]()
![]()
![]() 丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
![]() 丁组: Cu CuSO4
丁组: Cu CuSO4
(1)甲组实验用一个化学反应方程式表示: ;
使反应变快的可能原因是 ;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为 、
过滤并洗涤晶体,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在四组方案中, 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:
CuSO4![]() CuO+SO2↑+SO3↑+O2↑
CuO+SO2↑+SO3↑+O2↑
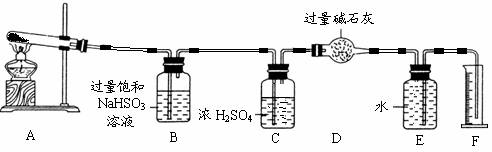 为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;
②实验结束时干燥管D总质
量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
(3)装置B的作用是 。
(4)装置C的作用是 。
(5)为减少测量气体体积引起的误差,应注意的事项有:
① 装置内气体的温度应恢复到室温,
② 调节量筒使其液面与E装置中的液面持平,
③ 。
(6)通过计算,推断出该条件下反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省南京市浦口区江浦高级中学高三(上)期中化学试卷(解析版) 题型:填空题
 CuO
CuO CuSO4
CuSO4  Cu(NO3)2
Cu(NO3)2 Cu(OH)2
Cu(OH)2 CuSO4
CuSO4 CuSO4
CuSO4 CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.
CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com