
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30min |
(1)该反应是_________反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________有关。
Ⅱ.某可逆反应在体积为5L的密闭容器中进行,在从0—3分钟各物质的物质的量变化情况如图所示(A、B、C均为气体)。
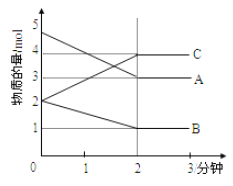
(3)该反应的的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
(6)由图求得A的平衡时的转化率为__________。
【答案】放热 催化剂的接触面积 2A+B![]() 2C 0.1 mol/(L·min) BC 40%
2C 0.1 mol/(L·min) BC 40%
【解析】
I.(1)试管发烫,说明反应为放热反应;
(2)根据试管发烫程度,反应剧烈程度、木条复燃情况,说明粉末状二氧化锰情况比块状的反应更剧烈;
II.(3)由物质的量的变化判断反应物与生成物,物质的量的变化量之比等于化学计量数之比;
(4)反应开始至2分钟时,B的变化量为1mol,再根据![]() 计算;
计算;
(5)可逆反应到达平衡时,同种物质表示的正逆反应速率相对,不同物质表示的正逆反应速率之比等于化学计量数之比,平衡时各组分的浓度、物质的量、含量保持不变,选择判断平衡的物理量由变化到不再变化,说明反应到达平衡;
I.(1)试管发烫,说明反应为放热反应;故答案为:放热;
(2)根据试管发烫程度,反应剧烈程度、木条复燃情况,说明粉末状二氧化锰情况比块状的反应更剧烈,粉末状接触面积更大,反应更剧烈,故催化剂的催化效果与 催化剂的接触面积有关,故答案为:催化剂的接触面积;
II.(3)随反应进行A、B物质的量减小,二者为反应物,C的物质的量增大,为生成物,△n(A):△n(B):△n(C)=2mol:1mol:2mol=2:1:1,故反应方程式为:2A+B![]() 2C,故答案为:2A+B
2C,故答案为:2A+B![]() 2C;
2C;
(4)反应开始至2分钟时,B的变化量为1mol,根据公式![]() ,求解
,求解![]() ;
;
(5)A.未指明只能速率,不能说明到达平衡,故A错误;
B.随反应进行混合气体总物质的量减小,容器内压强减小,压强保持不变,说明到达平衡,故B正确;
C.不同物质表示的正逆反应速率之比等于化学计量数之比,说明到达平衡,即v逆(A)=v正(C),故C正确;
D.容器内混合气体总质量不变,容器体积越大,容器内混合气体的密度始终保持不变,不能说明到达平衡,故D错误。
故选:BC;
(6)平衡时消耗的A为2mol,A的转化率=2mol÷5mol×100%=40%,故答案为:40%。


科目:高中化学 来源: 题型:
【题目】某烃分子中,碳、氢元素的质量比为5:1,相对分子质量为72。写出该烃的分子式及所有的同分异构体并用系统命名法命名。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列各组物质:A.O2和O3; B.126C和136C;C.冰醋酸和乙酸; D.甲烷和庚烷; E.CH3CH2CH2CH3和CH3CH(CH3)CH3; F.淀粉和纤维素;G.. 和
和 H.
H. 和
和![]() 。(填字母)
。(填字母)
①______组两物质间互为同位素。 ②______组两物质间互为同素异形体。
③______组两物质属于同系物。 ④______组两物质互为同分异构体。
⑤________组是同一物质。
(2)在下列变化中:①水的汽化、②NaCl熔化、③NaOH溶于水、④H2SO4溶于水、⑤O2溶于水、⑥NaHSO4溶于水、⑦Na2O2溶于水。
未发生化学键破坏的是________;(填序号,下同)仅破坏离子键的是________;仅破坏共价键的是________;既破坏离子键又破坏共价键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中常见的化学元素有20多种,其中有些含量较多,称为大量元素;有些含量很少,称为微量元素。下列各组元素中,全是微量元素的是
A.Fe、Mn、B、Mo、SB.C、H、O、Ca、Mg
C.P、N、K、Ca、MgD.Mo、Zn、Cu、B、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) ![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与 时间t的关系如图。图中t4时引起平衡移动的条件可能是______________________;图中表示平衡混合物中CO的含量最高的一段时间是____________。
(2)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是__________________ (提示:272 = 729)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________。
(2)下列物质中,不可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
II. 在实验室可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(3)乙酸分子中官能团的名称分别是_______。
(4)试管a中发生反应的化学方程式为______________;
反应类型是__________。
(5)反应开始前,试管b中盛放的溶液是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com