
| A. | 向海水中加入明矾可以使海水淡化,用于解决淡水供应危机 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 将地沟油回收再加工为食用油,以减缓水体富营养化 | |
| D. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 |
分析 A.明矾不能淡化海水;
B.生物防治技术能减少粮食的污染;
C.地沟油含有一些重金属和致癌物质,不能食用;
D.聚氯乙烯不能用作快餐盒.
解答 解:A.明矾可水解生成氢氧化铝胶体,具有吸附性,可除去水中的悬浮物而净化水,但不能使海水淡化,故A错误;
B.农药使用会污染环境,农药在农作物中会残留,危害人体健康,则大力推广农作物的生物防治技术,可以减少农药的使用,故B正确;
C.地沟油含有一些重金属和致癌物质,故不能回收为食用油,水体富营养化是由于含N、P元素的污水引起的,故C错误;
D.聚氯乙烯含有增塑剂等物质,且能释放出氯化氢,对人体有害,不能用作快餐盒,故D错误;
故选B.
点评 本题考查较为综合,题目难度不大,注意相关基础知识的积累即可解答该题,本题易错点为A,注意明矾净水的原理.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳在高温下和二氧化碳的反应 | B. | 碳不完全燃烧 | ||
| C. | 氯化铵与氢氧化钡晶体的反应 | D. | 铝和氧化铁在高温下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放电时,正极发生的反应是Pb+SO42-═PbSO4+2e- | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4+2e-═Pb+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
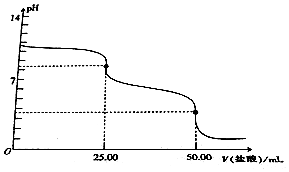
| A. | Na2CO3溶液的浓度为0.2mol•L-1 | |
| B. | 当V(盐酸)=0时,溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 当V(盐酸)=25.00mL时,溶液中:c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V(盐酸)=50.00mL时,溶液中:c(Na+)+c(H+)=c(OH-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔 | B. | 聚乙烯 | C. | 聚苯乙烯 | D. | 聚丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
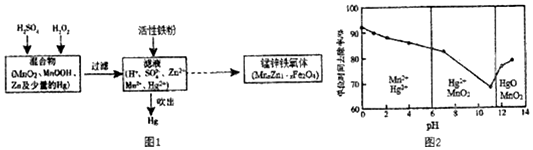
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com