
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
分析 求出过氧化钠的物质的量,设生成的氧气的物质的量为xmol,根据化学方程式中的计量数的关系可求出生成的氧气的物质的量.
根据题意可知,生成的氧气先和铜和铁的混合物反应,后用CO来还原所得的金属氧化物,故实际上相当于和CO反应的是氧气,设需要的CO的物质的量为ymol,根据CO和氧气的化学方程式即可求出Y.
解答 解:15.6g过氧化钠的物质的量n=$\frac{15.6g}{78g/mol}$=0.2mol,设生成的氧气的物质的量为xmol,根据方程式可知:
2Na2O2 +2H2O=4NaOH+O2↑
2 1
0.2mol xmol
故有:$\frac{2}{0.2mol}=\frac{1}{xmol}$
解得x=0.1mol
根据题意可知,生成的氧气先和铜和铁的混合物反应,后用CO来还原所得的金属氧化物,故实际上相当于和CO反应的是氧气,设需要的CO的物质的量为ymol,根据CO和氧气的化学方程式可知:
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2
2 1
ymol 0.1mol
故有:$\frac{2}{ymol}=\frac{1}{0.1mol}$
解得y=0.2mol
在标况下体积V=nVm=0.2mol×22.4L/mol=4.48L.
故选D.
点评 本题考查了过氧化钠和水的反应以及根据化学方程式的有关计算,难度不大,应注意的是简便方法的使用.


科目:高中化学 来源: 题型:选择题
| A. | 某温度时,化学反应速率无论用A、C何种物质表示,其数值都是相同的 | |
| B. | 其他条件不变时,升高温度,反应速率加快 | |
| C. | 其他条件不变时,增大压强,反应速率加快 | |
| D. | 若增加或减少A的物质的量,反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
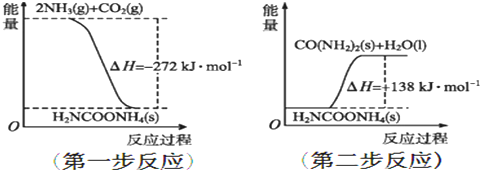
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原溶液中一定含有SCN- | B. | 原溶液中一定含有NO3- | ||
| C. | 原溶液可能呈酸性 | D. | Fe2+被Br2氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
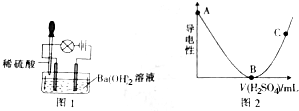
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
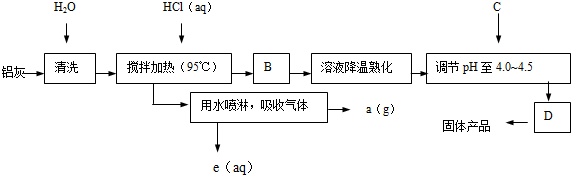
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com