
某地甲、乙两工厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成较严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清的只含硝酸钠的溶液而排放,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是( )
A.Na+和NO3-来自同一工厂 B.Cl-和Fe2+一定来自同一工厂
C.SO42-和Cl-来自同一工厂 D.Ag+和Na+可能来自同一工厂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液中加入过量氨水得到深蓝色溶液:Cu2++2OH-═Cu(OH)2↓ | |
| B. | 碳酸钠溶液中滴入酚酞试液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | FeCl2溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| D. | 90℃时,测得纯水pH=6.7,pH<7的原因是:H2O(l)?H+(aq)+OH-(aq)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
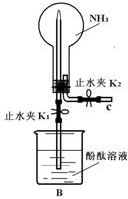 (1)甲同学用如图B装置做NH3喷泉实验,关闭K2,打开K1,用手捂热圆底烧瓶,一段时间后看到烧瓶内有红色喷泉现象.
(1)甲同学用如图B装置做NH3喷泉实验,关闭K2,打开K1,用手捂热圆底烧瓶,一段时间后看到烧瓶内有红色喷泉现象.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )
研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )| A. | d为石墨,铁片腐蚀加快 | |
| B. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- | |
| C. | d为锌块,铁片不易被腐蚀 | |
| D. | d为锌块,铁片上电极反应为:2H++2e-→H2↑ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:实验题
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
① 甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
② 乙直接加热饱和FeCl3溶液。
③ 丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法更合理: ,可以利用胶体的什么性质来证明有Fe(OH)3胶体生成? 。
(2)Fe(OH)3胶体稳定存在的主要原因是_________________。
A.胶粒直径小于1 nm B.胶粒带正电荷 C.胶粒作布朗运动 D.胶粒能透过滤纸
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是____________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间 B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质能透过滤纸
(4)提纯所制Fe(OH)3胶体常用的方法是________,若 向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
下列关于物质分类的说法正确的是( )
A.SO2、CO、CO2都是酸性氧化物
B.BaSO4、Ca(OH)2、KNO3溶液都是电解质
C.纯碱、烧碱、碱石灰都是碱
D.稀豆浆、牛奶、淀粉溶液都是胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
实验室有一瓶溶液,标签上标有“BaCl2 0.2 mol·L-1”的字样,下面是某同学对该溶液的叙述,正确的是( )
A. 配制500mL该溶液,可将0.1 mol BaCl2溶于500mL水中
B.Ba2+和Cl-的物质的量浓度都是0.1 mol·L-1
C.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2 mol·L-1
D.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 若电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | ${K}_{{a}_{1}}$=4.30×107 ${K}_{{a}_{2}}$=5.61×10-11 | Kh=1.77×10-5 |
| A. | 由数据可判断该溶液呈酸性 | |
| B. | c(NH4+)>c(HCO32-)>c(CO32-)>c(NH3•H2O) | |
| C. | c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用铁作阳极材料 | |
| B. | 电解过程中阳极附近溶液的pH升高 | |
| C. | 阳极反应方程式为:2Cl--2e-═Cl2↑ | |
| D. | 1 mol二价镍全部转化为三价镍时,外电路中通过 了2 mol 电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com