
 mA(g)+nB(g)?pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
mA(g)+nB(g)?pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )| A、m+n>p |
| B、n>p |
| C、X点时混合物的正反应速率小于逆反应速率 |
| D、X点比Y点混合物的反应速率慢 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、Na2CO3 |
| C、氨水 |
| D、MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=a的氨水稀释10倍后,其pH=b,则a=b+1 |
| B、浓度相同的①NH4Cl ②CH3COONH4③NH4HSO4,三种溶液中的c(NH4+):①>③>② |
| C、将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:c (NH4+)>c (Cl-)>c (H+)>c (OH-) |
| D、将a mol?L-1CH3COOH与b mol?L-1NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,2v正(O2)=v逆(SO3) |
| B、达到化学平衡时,容器中气体压强不再变化 |
| C、若单位时间内生成xmolSO3的同时消耗xmolSO2,则反应达到平衡状态 |
| D、达到化学平衡时,容器中混合气体的平均相对分子质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
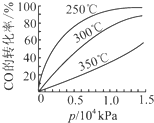 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②>①>③ |
| B、③>①>② |
| C、③>②>① |
| D、①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气具有氧化性,用浓氨水检验氯气管道是否泄漏 |
| B、金属镁着火可用干粉灭火器灭火,也可用泡沫灭火器灭火 |
| C、二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气 |
| D、铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com