
���� ��1����֪��a��2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g��
b��4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g��
���ݸ�˹���ɣ����2-��ɵã�2NO��g��+Cl2��g��?2ClNO��g�����ʱ�Ҳ������Ӧ���㣬�÷�Ӧƽ�ⳣ������I��ƽ�ⳣ��ƽ����II��ƽ�ⳣ�����̣�
��2�����10min��v��ClNO��=7.5��10-3mol•L-1•min-1�����n��ClNO��=7.5��10-3mol•L-1•min-1��10min��2L=0.15mol���ɷ���ʽ����μӷ�ӦNO�����������ʵ�������������ƽ��ʱ���������ʵ�����NO��ת���ʣ�����ӦΪ�������ʵ�����С�ķ�Ӧ�����º����������£�����ƽ��ʱѹǿ����ʼѹǿС�������������ֲ��䣬��Ӧa�ں�ѹ�����½��У���ЧΪ�ں��º����µ�ƽ�����������ѹǿ��ƽ�������ƶ���ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��
��� �⣺��1����֪��a��2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g��
b��4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g��
���ݸ�˹���ɣ�a��2-b�ɵã�2NO��g��+Cl2��g��?2ClNO��g�����÷�Ӧ��=2��H1-��H2��ƽ�ⳣ��K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$��
�ʴ�Ϊ��$\frac{{{K}_{2}}^{2}}{{K}_{1}}$��2��H1-��H2��
��2�����10min��v��ClNO��=7.5��10-3mol•L-1•min-1�����n��ClNO��=7.5��10-3mol•L-1•min-1��10min��2L=0.15mol��
�ɷ���ʽ��֪���μӷ�Ӧ���������ʵ���Ϊ0.15mol��$\frac{1}{2}$=0.075mol����ƽ��ʱ���������ʵ���Ϊ0.1mol-0.075mol=0.025mol��
�μӷ�ӦNO���ʵ���Ϊ0.15mol����NO��ת����Ϊ$\frac{0.15mol}{0.2mol}$��100%=75%��
����ӦΪ�������ʵ�����С�ķ�Ӧ�����º����������£�����ƽ��ʱѹǿ����ʼѹǿС�������������ֲ��䣬a�ں�ѹ�����½��У���ЧΪ�ں��º����µ�ƽ�����������ѹǿ��ƽ�������ƶ���NOת��������ת���ʦ�1����2��
ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��
�ʴ�Ϊ��0.025��75%���������䣻�����¶ȣ�
���� ���⿼���˸�˹���ɵ�Ӧ�á���ѧƽ�������Ӱ�����ء���ѧƽ�ⳣ����֪ʶ����ֿ���ѧ���ķ������������ͼ�����������Ҫѧ���߱���ʵ�Ļ��������Ӧ���������Ѷ��еȣ�


 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�����ĵ�Zn������Ϊ97.5 g | B�� | ����A��SO2��H2�������Ϊ1��4 | ||
| C�� | ��Ӧ�б���ԭ��Ԫ��ֻ��һ�� | D�� | ��Ӧ�й�ת�Ƶ���3 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ż�ʱʹ����ĭ�������� | |
| B�� | ���Թܼ���̼�����ƹ���ʱʹ�Թܿ���ֱ���� | |
| C�� | Ũ���ὦ��Ƥ����ʱ������ϡ����������Һ��ϴ | |
| D�� | ����ʱӦ������������ͨ������ˮ�ټ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol����������������ȫ��Ӧ����ʧȥ�ĵ�����Ϊ0.3NA | |
| B�� | 3.4g NH3�к�ԭ������ĿΪ0.6NA | |
| C�� | ���Ƶĺ�NA��Fe��OH��3���ӵ��������������У����н��������ʵ���Ϊ1mol | |
| D�� | 23gNO2��N2O4�Ļ�������к���ԭ������1.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
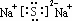 ����ˮ��Һ������Ũ���ɴ�С��˳����c��Na+����c��S2-����c��OH-����c��HS-����c��H+����
����ˮ��Һ������Ũ���ɴ�С��˳����c��Na+����c��S2-����c��OH-����c��HS-����c��H+�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com