
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是弱电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
分析 往氢氧化钡溶液中滴加硫酸至过量,发生反应生成硫酸钡和水,溶液的离子浓度先减小后增大;向盐酸溶液中加入少量氢氧化钠固体,反应生成了氯化钠和水,溶液中离子浓度变化很小,所以溶液的导电性与溶液的离子浓度大小有关,离子浓度越大,则溶液导电性越强,灯泡越亮,反之越暗.
解答 解:A.溶液的导电性与溶液中离子的浓度有关,溶液中离子浓度越大,溶液导电性越强,故A正确;
B.溶液的导电性与溶液中离子浓度有关,与溶液中离子种类无关,故B错误;
C.BaSO4是强电解质,故C错误;
D.往氢氧化钡溶液中滴加硫酸至过量,会生成难溶的硫酸钡和难电离的水,所以导电性会先减弱,硫酸过量之后,导电性又增强,所以,灯泡的明亮度变化是:明→暗→明,而往氢氧化钡溶液中滴加盐酸,生成的是易溶易电离的氯化钡,所以,溶液导电能力一直很强,灯泡一直明亮,故D错误.
故选A.
点评 本题考查电解质溶液的导电性,题目难度不大,注意把握溶液导电性与离子浓度的关系,注意把握溶液中的离子反应为解答该题的关键,试题有利于培养学生提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
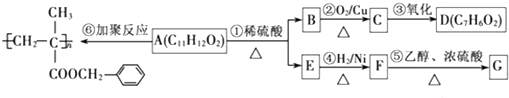
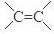 、-COOH;F的名称2-甲基丙酸(系统命名法命名).
、-COOH;F的名称2-甲基丙酸(系统命名法命名).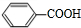 .
.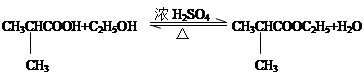 .⑤的反应类型是酯化反应(或取代反应).
.⑤的反应类型是酯化反应(或取代反应).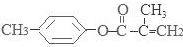 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
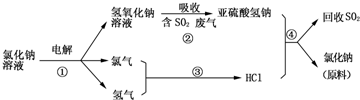
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
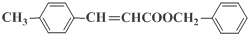 )的流程:
)的流程: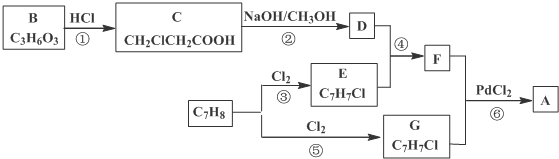
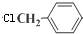
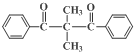 、、
、、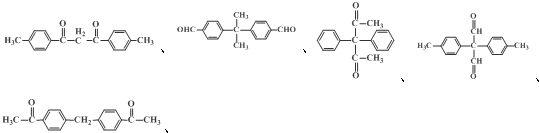 (其中两种).
(其中两种).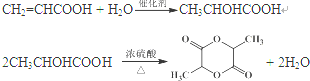 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gNH${\;}_{4}^{+}$和2.3gNa+所含的电子数均为NA | |
| B. | 0.4molCu与0.8molHNO3(稀)反应,转移电子数为0.8NA | |
| C. | 3.2gCu与足量的HNO3(浓)反应生成的气体分子数为0.1NA | |
| D. | 1molCl2与足量的铁反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
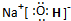 ,写出③中生成盐的化学键类型离子键和共价键.
,写出③中生成盐的化学键类型离子键和共价键.| 物质 | F(OH)2 | I(OH)3 |
| Ksp | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com