
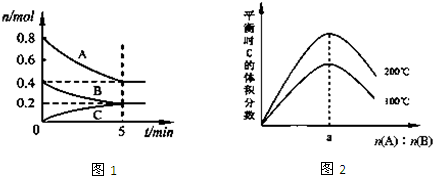
| A��200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v��B��=0.04mol?L-1?min-1 |
| B��ͼ2��֪��ӦxA��g��+yB��g��?zC��g���ġ�H��0����a=2 |
| C������ͼ1��ʾ��ƽ��״̬�£�������ϵ�г���He����ʱv����v�� |
| D��200��ʱ���������г���2mol A��1mol B���ﵽƽ��ʱ��A���������С��0.5 |
| ||
| ��t |
| ||
| 5min |
| 0.4mol |
| 0.4mol+0.2mol+0.2mol |


 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH2Br-CH2Br �������� |
| B��CH3OOCCH3 ������� |
C��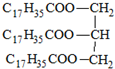 Ӳ֬�����֬ Ӳ֬�����֬ |
D��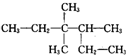 3��3-����-4-�һ����� 3��3-����-4-�һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
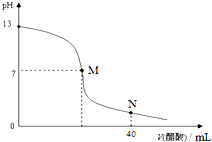
| A����M�㣬����ǡ�÷�Ӧ��ȫ |
| B��NaOH��Һ�����ʵ���Ũ��Ϊ0.1 mol/L |
| C���ζ�ǰ������c��H+�����ڼ���c��OH-�� |
| D����N�㣬c��CH3COO-��+c��CH3COOH��=c��Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HF��HCl��BaSO4 |
| B��NH4Cl��CH3COONa��Na2S |
| C��NaOH��Ca��OH��2��NH3?H2O |
| D��HClO��NaF��Ba��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��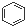 �� ��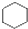 ���Ƿ������� ���Ƿ�������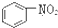 ���Ƿ��������Ƿ��㻯���� ���Ƿ��������Ƿ��㻯���� |
B�� �� �� ����������һ��-CH2-�������ͬϵ���ϵ ����������һ��-CH2-�������ͬϵ���ϵ |
| C����Ȼ����������������ú������Ҫ�ɷֶ��Ǽ��� |
| D������ʽΪC4H10O�����ʣ��������ڴ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ�����c��OH-��=1��10-12mol/L����Һ�У�Ba2+��K+��Br-��SiO32-һ���ܴ������� |
| B�����Ȼ�����Һ�м�������İ�ˮ���ӷ���ʽ�ǣ�Al3++4NH3?H2O�TAlO2-+4NH4++2H2O |
| C��1.0L 0.3mol?L-1 NaOH��Һ����ͨ��CO2��������Һ����8.8g��������Һ�У�c��Na+��=c��HCO3-��+2c��CO32-��+c��OH-��-c��H+�� |
| D��0.1mol?L-1 CH3COONa��Һ�У�c��OH-����c��CH3COOH��+c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��FeCl3�백ˮ��Ӧ��Fe3++3NH3?H2O�TFe��OH��3��+3NH4+ |
| B��ͭ��ϡ���ᷴӦ��Cu+8H++2NO3-�TCu2++2NO��+4H2O |
| C��NO2��ˮ��Ӧ��3NO2+H2O�TNO3-+NO+2H+ |
| D��������CaCO3��Ӧ��CaCO3+2H+�TCa2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com