
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a=_______。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为_____________。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)=____________。
(4)原混合气体中a : b=_______________。
(5)达到平衡时,N2和H2的转化率![]() (N2):
(N2):![]() (H2)=______________。
(H2)=______________。
(6)平衡混合气体中n(N2): n(H2): n(NH3)=______________。
【答案】16mol 8mol 5:4 2:3 1:2 3:3:2
【解析】
(1)根据三段式计算;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)利用差量法计算原混合气体的物质的量;
(4)原混合气体的物质的量减去氮气的物质的量为氢气的物质的量,据此计算;
(5)根据差量法计算出反应消耗的氮气和氢气的物质的量,计算出转化率;
(6)根据①②中数据计算出达到平衡时,反应混合物各组分的物质的量,据此计算。
(1)根据方程式计算:
N2(g)+3H2(g)2NH3(g),
起始: a b 0
转化: 3 9 6
t时刻:a3 b9 6
a3=13,则a=16,
故答案为:16;
(2)反应达平衡时,混合气体为![]() =32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
=32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
(3) N2(g)+3H2(g)2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化: 4mol 12mol 8mol 8mol
故原混合气体为32mol+8mol=40mol,
则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4,
故答案为:5:4;
(4)由(1)知a=16mol,则b=40mol16mol=24mol,所以:a:b=16mol:24mol=2:3,
故答案为:2:3;
(5)反应转化的氮气物质的量为4mol,转化率为:![]() ×100%=25%,
×100%=25%,
转化的氢气物质的量为12mol,转化率为:![]() ×100%=50%,
×100%=50%,
达到平衡时,N2和H2的转化率之比a(N2):a(H2)=25%:50%=1:2,
故答案为:1:2;
③平衡混合气的组成为:N2为16mol4mol=12mol,NH3为8mol,H2为32mol12mol8mol=12mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,
故答案为:3:3:2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 按系统命名法, ![]() 的名称为2,6二甲基5乙基庚烷
的名称为2,6二甲基5乙基庚烷
B. 丙氨酸和甘氨酸脱水,最多可生成4种二肽
C. 化合物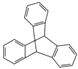 是芳香族化合物
是芳香族化合物
D. 三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
A. SO2、O2浓度分别为0.4 mol·L-1、0.2 mol·L-1
B. SO3浓度为0.25 mol·L-1
C. SO3浓度为0.4 mol·L-1
D. SO3、SO2浓度均为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
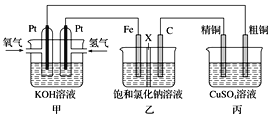
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应化学方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是_________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示实验,探究反应中的能量变化。

下列判断正确的是
A. 由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B. 将实验(a) 中的等质量的铝片换成铝粉后,释放出的热量有所增加
C. 实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D. 若用NaOH固体测定中和热,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.基态Cr原子有6个未成对电子
B.PH3和NH3分子中均含有孤电子对,且PH3提供孤电子对的能力强于NH3
C.BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向1mol配合物![]() 中加入足量AgNO3溶液,可以得到3molAgCl沉淀
中加入足量AgNO3溶液,可以得到3molAgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mA(s)+nB(g)qC(g) △H<0的可逆反应,在一定温度下达平衡时,B的体积分数ф(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )

A. m+n<qB. n>q
C. x点的混合物中v (正)<v (逆)D. x点比y点的混合物的正反应速率小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:![]() ,
,![]() ,
,![]() 。
。
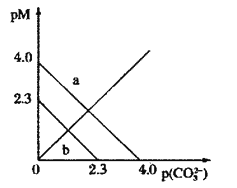
下列说法正确的是( )
A.线a表示YCO3的溶解平衡曲线
B.![]()
C.t℃时,向XCO3悬浊液中加入饱和![]() 溶液,可能有YCO3生成
溶液,可能有YCO3生成
D.t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知六种物质:①H2O ②氨水③ Mg ④ HNO3 ⑤Ba(OH)2 ⑥CuSO4·5H2O
根据上述提供的物质,回答下列问题:
(1)属于电解质的是________(填序号,下同)。
(2)上述物质中④与⑤反应的离子方程式为_________。
(3)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为________g。在配制过程中,若其它操作均正确,则下列操作会使所配溶液物质的量浓度偏低的是_________(填字母序号)。
A 溶解后小烧杯、玻璃棒没有洗涤
B 所用容量瓶中,已有少量蒸馏水
C 定容摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
D 定容时俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com