
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.氢氧化钠溶液和稀盐酸反应:H++OH-===H2O
B.大理石与盐酸反应制取二氧化碳:CO32-+ 2H+=== H2O + CO2↑
C.铁粉投入FeCl3溶液中:Fe + Fe3+===2Fe2+
D.用小苏打治疗胃酸过多:CO32-+ 2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
扑热息痛是一种解热镇痛药,结构式为 。下列说法中错误的是
A.扑热息痛的分子式为C8H9NO2
B.扑热息痛可与烧碱溶液、浓溴水溶液发生反应
C.扑热息痛很稳定,不容易被氧化
D.扑热息痛核磁共振氢谱上有5个峰,峰面积之比为1︰1︰2︰2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管2,再测试管2中有机层的厚度,实验记录如下:
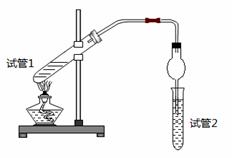
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
(1)写出实验A中试管1反应的化学方程式________________________________。
(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
(3)分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 ___ 。
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物分子中,在核磁共振谱图中能给出4种信号的是
A.CH2= CH2 B.HCOOCH3 C.CH3COOCH2CH2CH3 D.CH3 CH2CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
阿斯匹林的结构简式为: 则1mol阿斯匹林跟足量氢氧化钠溶液
充分反应,消耗氢氧化钠的物质的量为
A、1mol B、2mol C、3mol D、4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清的溶液,其中可能含有NH 、K+、Mg2+、Ba2+、Al3+、Fe3+、SO
、K+、Mg2+、Ba2+、Al3+、Fe3+、SO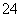 、CO
、CO 、NO
、NO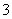 和I-。取该溶液进行以下实验:
和I-。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后,CCl4呈紫红色;
(3)另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中,溶液中均无沉淀生成;
(4)取部分上述碱性溶液加热,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定: 在该溶液中肯定存在的离子是______________,肯定不存在的离子是________________________________________________________________________
______________,还不能确定是否存在的离子是________。如何检验不能确定的离子是否存在?________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2+M===NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com