
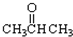 ③CH3CH2Br ④
③CH3CH2Br ④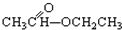 ⑤
⑤ ⑥
⑥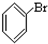 ⑦
⑦ ⑧
⑧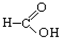 ⑨
⑨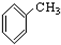 ⑩
⑩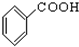
分析 (1)芳香烃是仅含有碳氢元素且含有苯环的有机化合物;
(2)烃分子中的氢原子被卤素原子取代后的化合物称为卤代烃;
(3)醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物;
(4)羟基直接连接在苯环碳原子上的属于酚.
解答 解:(1)从结构分析,芳香烃必须含有苯环,从元素组成看,芳香烃只含有碳、氢两种元素.符合这两个条件的上述有机化合物只有⑨,故答案为:⑨;
(2)从元素组成来看,卤代烃含有碳、氢、卤素(F、Cl、I)等元素,但不含其他原子.符合该条件的上述有机化合物有③⑥,故答案为:③⑥;
(3)醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物,如上述有机化合物①属于醇,故答案为:①;
(4)酚就像上述有机化合物⑤,羟基是直接连接在苯环碳原子上的,故答案为:⑤.
点评 本题考查有机物的结构,把握有机物中的官能团为解答的关键,侧重于学生的分析能力的考查,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烷体积比为1:4 | B. | 乙烯与丁烷体积比为4:1 | ||
| C. | 丙炔与乙炔物质的量比为4:1 | D. | 乙烯与丁烯物质的量比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O的体积(mL) | ||||
| 体积(mL) | 浓度(mol•L-1) | 体积(mL) | 浓度(mol•L-1) | |||
| A | 10 | 5.0 | 0.10 | 10.0 | 0.10 | 5.0 |
| B | 10 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| C | 30 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| D | 30 | 5.0 | 0.20 | 5.0 | 0.10 | 10.0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com