
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
4NH3(g)+5O2(g)  4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH2=-114.2 kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ΔH3=-71.7kJ/mol
回答下列问题:
(1)NH3(g)+2O2(g)=HNO3(aq)+H2O(l)的ΔH=___________kJ/mol。
原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是________。
(2)研究表明2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g) ![]() N2O2(g)(快) (b)N2O2(g)+O2(g)
N2O2(g)(快) (b)N2O2(g)+O2(g) ![]() 2NO2(g) (慢)
2NO2(g) (慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的_____(填“大”或“小”)。
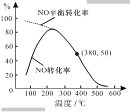
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如右图,则150℃时,v正____v逆(填“>”或“<”)。若起始c(O2)=5.0×104mol·L1,则380℃下反应达平衡时c(O2)=_______ mol·L1。
(3)T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+O2=2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
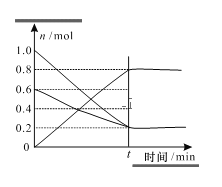
①下列说法能表明该反应已经达到平衡状态的是_______(填序号)
A.混合气体的密度不变
B.混合气体的颜色不变
C.k正、k逆不变
D.2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=___________。
③温度为T1时的化学平衡常数K=_________。若将容器的温度变为T2时k正=k逆,则T2 _______T1(填“>” “<”或“=”)。
【答案】- 413.8 防止催化剂中毒,影响生产效率 b > 2.5×104mol·L1 BD ![]() 160 >
160 >
【解析】
⑴利用盖斯定律求算焓变,脱硫处理主要目的是防止催化剂中毒,影响生产效率;
⑵①活化能越大,反应速率越慢,活化能越小,反应速率越慢;
②开始阶段正在建立平衡的阶段,最高点以后是温度影响平衡移动,在150℃时,处于建立平衡的阶段,正反应速率大于逆反应速率,因此v正>v逆,利用三步走进行计算;
⑶①利用判断化学平衡状态的标志进行判断,再利用正逆反应速率相等得出化学平衡常数K与速率常数k正、k逆的数学关系,再根据图中数据进行计算K和判断T2 与T1相对高低。
⑴将第1个方程式乘以0.25,加上第二个方程式的0.75倍,加上第3个方程式的0.5倍,得出NH3(g)+2O2(g)=HNO3(aq)+H2O(l)的ΔH= (-1169.2)×0.25 +(-114.2)×0.75 + (-71.7)×0.5 = - 413.8 kJ/mol,原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是防止催化剂中毒,影响生产效率,故答案为:- 413.8;防止催化剂中毒,影响生产效率;
⑵①活化能越大,反应速率越慢,活化能越小,反应速率越慢,因此b步反应的活化能比a步的大,故答案为:b;
②开始阶段正在建立平衡的阶段,最高点以后是温度影响平衡移动,在150℃时,处于建立平衡的阶段,正反应速率大于逆反应速率,因此v正>v逆,
2NO(g) + O2(g) ![]() 2NO2(g)
2NO2(g)
开始(mol·L1):1.0×103 5.0×104 0
转化(mol·L1):5.0×104 2.5×104 5.0×104
平衡(mol·L1):5.0×104 2.5×104 5.0×104
因此380℃下反应达平衡时c(O2)=2.5×104mol·L1,故答案为:>;2.5×104mol·L1。
⑶①A选项,![]() ,气体密度不变,容器体积不变,混合气体的密度始终不变,故A不能作为判断平衡标志;
,气体密度不变,容器体积不变,混合气体的密度始终不变,故A不能作为判断平衡标志;
B选项,二氧化氮是红棕色,当混合气体的颜色不变达到平衡,故B能作为判断平衡标志;
C选项,k正、k逆只与温度有关,恒温,k正、k逆始终不变,故C不能作为判断平衡标志;
D选项,2v正(O2)=v逆(NO2),一个正向,一个逆向移动,速率之比等于计量系数之比,故D能作为判断平衡标志。
综上所述,答案为BD。
②k正c2(NO)c(O2) = k逆c2(NO2),化学平衡常数K与速率常数k正、k逆的数学关系式K=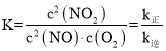 ,故答案为:
,故答案为:![]() 。
。
③根据图像c(NO) =0.2 mol,c(O2) =0.2 mol,c(NO2) =0.8 mol,温度为T1时的化学平衡常数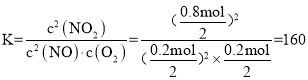 ,若将容器的温度变为T2时k正=k逆,K = 1,反应为放热反应,则升温平衡常数减小,则T2 >T1,故答案为:160;>。
,若将容器的温度变为T2时k正=k逆,K = 1,反应为放热反应,则升温平衡常数减小,则T2 >T1,故答案为:160;>。


科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z都是短周期主族元素,X、Y、Q在周期表中的位置关系如图所示,W、Z的最外层电子数相同,Z的核电荷数是W的2倍,则下列说法不正确的是( )
ⅠA | ⅡA | ⅢA | ⅣA |
Q | |||
X | Y |
A.非金属性:![]()
B.原子半径:![]()
C.最高价氧化物对应水化物的碱性:![]()
D.最简单氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z均为主族元素,分析表中数据,判断下列说法正确的是(a≠b)( )
元素 | X | Y | Z |
最外层电子数 | a | b | a |
原子半径/nm | 0.154 | 0.130 | 0.211 |
A.X与Y位于同一主族,且X在Y的上一周期
B.X与Z位于同一主族,且X在Z的下一周期
C.X与Z位于同一周期,且X的原子序数小于Z的原子序数
D.X与Z位于同一主族,且X的原子序数小于Z的原子序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“![]() ”或“
”或“![]() ”回答下列问题。
”回答下列问题。
(1)酸性:H2CO3 ______H2SiO3,H2SiO3 ______H3PO4。
(2)碱性:Ca(OH)2 ______Mg(OH)2,Mg(OH)2 ______Al(OH)3。
(3)简单氢化物的稳定性:H2O ______H2S,H2S ______HCl。
(4)还原性:H2O ______H2S,H2S ______HCl。
(5)酸性:H2SO4 ______H2SO3,HClO4 ______HClO。
(6)从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应的水化物的酸性越______;
②元素的金属性越强,其最高价氧化物对应的水化物的碱性越______;
③元素的______性越强,其对应简单氢化物的稳定性越强;
④非金属性越强的元素生成的简单氢化物的还原性越______;
⑤同种非金属元素形成的氧化物对应的水化物,其成酸元素的价态越高,其酸性越______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体![]() 的化学式为
的化学式为![]() ,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
A.![]() 中既有离子键又有共价键B.
中既有离子键又有共价键B.![]() 的熔、沸点高于
的熔、沸点高于![]()
C.![]() 中含有
中含有![]() 键D.
键D.![]() 形成的晶体是离子晶体
形成的晶体是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 三种晶体,分别由
三种晶体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 |
| 801 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| 3500 | 很大 | 不溶 | 不导电 | 不反应 |
|
| 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为![]() ______;
______;![]() ______。
______。
(2)晶体的类型分别为![]() ______;
______;![]() ______,
______,![]() ______。
______。
(3)![]() 、
、![]() 晶体中粒子间的作用力分别为______、______。
晶体中粒子间的作用力分别为______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
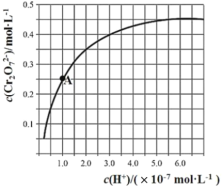
A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素. 铁、钴、镍都是很好的配位化合物形成体.
(1)[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。H2O 和 N H3 中与 Co2+配位能力较强的是_____,[Co(H2O)6]2+中 Co2+的配位数为___;从轨道重叠方式看,NH3 分子中的化学键类型为___ , H2O 分子的立体构型为___。
(2)铁、镍易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数 遵循 18e-规则。如:Fe(CO)5,则镍与 CO 形成的配合物化学式为_________。常温下 Fe(CO)5 为 黄色油状液体,则 Fe(CO)5 固态为_____晶体。Fe(CO)5 晶体中存在的作用力有___,写出与 CO 互为等电子体的一种阴离子的离子符号_____,Fe(CO)5 中σ键和π键数目之比为______。
(3)一种铁单质其晶胞与钠、钾晶胞相同,如果该铁单质的晶胞参数为 a cm,则相距最近的两 个铁原子核间距为_____cm (用含 a 的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com