
|
下列溶液中含Cl-物质的量浓度最大的是 | |
| [ ] | |
A. |
10 mL 0.1 mol/L的AlCl3溶液 |
B. |
20 mL 0.1 mol/L的CaCl2溶液 |
C. |
30 mL 0.2 mol/L的KCl溶液 |
D. |
100 mL 0.25 mol/L的NaCl溶液 |
科目:高中化学 来源: 题型:
 含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.查看答案和解析>>
科目:高中化学 来源: 题型:

 +HIO4→R1CHO+R2CHO+HIO3+H2O
+HIO4→R1CHO+R2CHO+HIO3+H2O

| 500~600℃ |
| 500~600℃ |
| △ |
| △ |
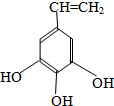 、
、
 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:| O | - 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源:2010年东北三省联考高考化学一模试卷(解析版) 题型:解答题
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
 ?
?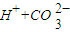
 、
、 在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题: 的pC最大值为______(溶液中的离子浓度小于1×10-5mol/L时,沉定完全).
的pC最大值为______(溶液中的离子浓度小于1×10-5mol/L时,沉定完全). 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于______mol.
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于______mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com