



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 50-80℃ |
| 180-200℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A、O2在石墨Ⅱ附近发生氧化反应 |
| B、该电池放电时NO3-向石墨Ⅱ电极迁移 |
| C、石墨Ⅰ附近发生的反应:3NO2+2e-=NO+2NO3- |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 符号 | 元素原子结构 |
X | 原子结构示意图为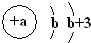 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化物的沸点:HF<HCl<HBr<HI |
| B、CaF2、CaCl2、CaBr2、CaI2的溶解性依次减小 |
| C、AgF、AgCl、AgBr、AgI的溶解性依次减小 |
| D、F2、Cl2、Br2、I2氧化性逐渐减弱,都能与Fe反应生产Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙醇分子中甲基的电子式为 |
| B、乙醇结构简式为:C2H6O |
C、乙醇分子中羟基电子式: |
D、乙醇分子的比例模型为: |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 浓硫酸 |
| △ |
| 加热方式 | 通CO加热 时间/min | 澄清石灰水变 浑浊时间/min | 产物颜色 | 产物能否全部 被磁铁吸引 |
| 酒精灯 | 30 | 5 | 黑色 | 能 |
| 酒精喷灯 | 30 | 1 | 黑色 | 能 |
| 样品序号 | 加热方式 | 元素组成和质量分数 |
| 产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
| 产物样品II | 酒精喷灯 | w(Fe)=100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
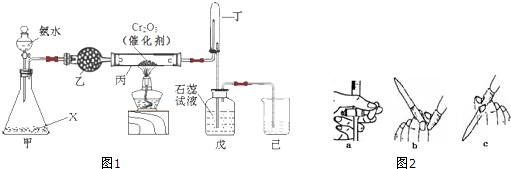
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com