
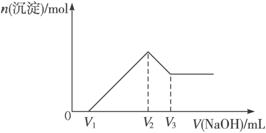
若保持混合物总物质的量不变,Al2O3与Fe2O3按不同比例混合进行上述实验(其他条件不变),当![]() 变大时,关于V1、V2、V3的变化的判断正确的是( )
变大时,关于V1、V2、V3的变化的判断正确的是( )
A.V1变大 B.V2不变 C.V3变小 D.(V3-V1)不变
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:福建省福州八县(市)一中2012届高三上学期期中联考化学试题 题型:058
利用某炉渣(只含Fe2O3、FeO、SiO2、Al2O3)可制备新型净水剂碱式氯化铝[Al2(OH)nCl6-n]和Fe2O3.工艺流程如下:
①用3.00 mol/L的盐酸稀盐酸浸取炉渣,过滤.
②滤液先用H2O2氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3
③将第②步分离出沉淀的滤液通CO2调pH值后,保持温度在90~100℃进行“蒸发浓缩”,可以得到碱式氯化铝[Al2(OH)nCl6-n]
据以上信息回答下列问题:
(1)实验室配制3.00 mol/L的盐酸100 mL需要36.5%的浓盐酸(密度为1.2 g/cm3)________mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、________.
(2)写出
H2O2与滤液反应的化学方程式________(3)
“蒸发浓缩”需保持温度在90~100℃,可采用的加热方法是________(4)
为验证炉渣中含有Fe2O3,做如下实验:a取适量炉渣于烧杯中,加足量________溶解、静置
b取上层清液少量于试管中,滴加________,观察现象.选用提供的试剂,
提供的试剂:
①稀硝酸
②稀硫酸
③氯水
④KMnO4溶液
⑤KSCN溶液
步骤a、b中所加试剂分别为________;
步骤b中反应的离子方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)配平可逆反应:![]()
已知400℃时,1.6 mol NO和NH3混合气体发生以上反应达到平衡后,混合气体的物质的量变为1.7 mol,则被氧化的N的物质的量为 。
(2)已知某温度下0.01 mol/L盐酸溶液中水电离的c(H+)=l x 10-11mol/L,则Kw= ;若在此温度下将pH==a的NaOH溶液与pH=b的盐酸按1:100体积刚好完全反应,a、b应满足关系为 。
(3)有一种白色固体,可能含有CaCO3、Ba(N O3)2、NH4 C1、KCl、A gN O3、Al2(SO4)3
和KMnO4中的一种或几种。①将白色固体用水溶解并过滤,②将滤渣加入足量盐酸中,滤渣全部溶解并放出气体;③向滤液中加入足量浓NaOH溶液,加热,放出能使湿润红色石蕊试纸变蓝的气体,待溶液冷却后,继续滴入适量的稀盐酸,有白色沉淀产生。则该白色固体中一定有 ,可能有 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊高密市高三4月月考理综化学试卷(解析版) 题型:填空题
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为???????????????????????????????????? 。
(2)下列实验能比较镁和铝的金属性强弱的是???? ??? ?? (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s)??? ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s)???? ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是?????????????????????? ????? 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为??????????????????? ????????? ???????????? 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g)  Si3N4(s) + 12HCl(g)?? △H<0??
Si3N4(s) + 12HCl(g)?? △H<0??
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是???????? mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应????? (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=?????????????? 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为????? 以上。
查看答案和解析>>
科目:高中化学 来源: 题型:
①2Al+3H2SO4====Al2(SO4)3+3H2↑
Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4
②2Al+2NaOH+2H2O====2NaAlO2+3H2↑
2NaAlO2+H2SO4+2H2O====2Al(OH)3↓+Na2SO4
(1)请将每制取2 mol Al(OH)3所耗费的酸、碱用量记录于下表中,然后说明哪一种方法比较节约试剂。
途 径 | 生成2 mol Al(OH)3所消耗酸碱的物质的量 | |
| n(H2SO4)/mol | n(NaOH)/mol |
①Al→Al3+→Al(OH)2 ②Al→ |
|
|
(2)原料相同,请设计一种更节约试剂,且操作更为简单的方法,(提示:从反应终点是否易于控制角度考虑)。用化学方程式表示并予以说明。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com