
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O ,把8.7gMnO2放入浓盐酸中完全反应,计算:
MnCl2+Cl2↑+2H2O ,把8.7gMnO2放入浓盐酸中完全反应,计算:
(1)8.7gMnO2的物质的量___________;
(2)参加反应的HCl的物质的量__________;
(3)生成Cl2的体积________________(标准状况)。
科目:高中化学 来源: 题型:
【题目】绿原酸(见右图)是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法正确的是( )
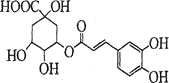
A.绿原酸的分子式为C16H20O9
B.绿原酸既能和溴水发生加成反应,又能发生取代反应
C.1 mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH
D.咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
A. CH3COOH电离程度变大 B. 溶液pH减小 C. 溶液的导电能力减弱 D. 溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱电解质的电离平衡常数如表:
弱电解质 | HCOOH | HCN |
|
|
电离平衡常数 |
|
|
|
|
下列说法错误的是![]()
A.结合![]() 的能力:
的能力:![]()
B.![]() 的
的![]() 溶液中存在以下关系式:
溶液中存在以下关系式:![]()
C.![]() 的盐酸与
的盐酸与![]() 的氨水混合,若溶液显中性,则
的氨水混合,若溶液显中性,则![]() 盐酸
盐酸![]() 氨水
氨水![]()
D.等体积、等浓度的HCOONa和NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是![]()
![]()
A.b一定显中性B.b可能显碱性或酸性
C.a不可能显酸性D.a可能显酸性或碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
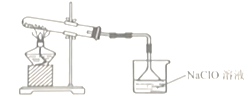
【题目】肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO + 2NH3 = N2H4 + NaCl + H2O制取。某化学兴趣小组尝试在实验室制取N2H4,设计了如下实验:
(1)制备NaClO溶液,装置如图所示。(已知:3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O)
5NaCl + NaClO3 + 3H2O)

①仪器A的名称是________________。
②连接好装置,装药品之前,必须进行的一项操作是_________。
③圆底烧瓶内发生反应的化学方程式为_______________;当生成71g氯气时,被氧化的HCl为_________mol。试管内发生反应的离子方程式为_________。
④饱和食盐水的作用是_____________,冰水的作用是____________。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。制取氨气的化学方程式为_______。
(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质。写出该反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组查阅资料,设计以下流程验证 SO2 的还原性。
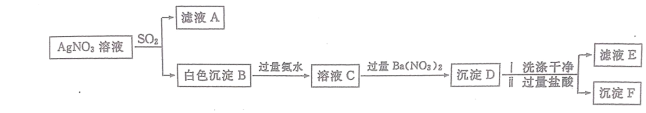
已知:沉淀 D 洗涤干净,加入过量盐酸时,部分沉淀溶解,剩余少量沉淀 F。(1)关于“白色沉淀 B”的成份
①甲同学推断白色沉淀 B 含 Ag2SO4。
实验现象依据:“沉淀 F”说明“沉淀 D”中含________________ (填化学式),进而说明“白色沉淀B"中含 Ag2SO4。
②乙同学认为“白色沉淀 B”中含有 Ag2SO3。
实验现象依据:“沉淀 D 洗涤干净,加入过量盐酸时,部分沉淀溶解”,溶解的物质为 BaSO3, 进而推断沉淀 B 中含 Ag2SO3。为进一步证实 B 中含有 Ag2SO3,可取少量滤液 E于试管中加入少量________________,有白色沉淀生成。
(2)常温下,Ag2SO4 与 Ag2SO3 中 c(Ag+)与 c(SO32-)的关系如下图所示:
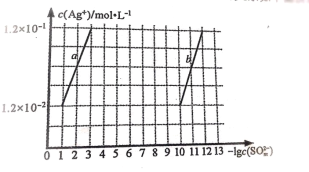
已知:Ksp(Ag2SO4)>Ksp(Ag2SO3),回答问题:
①表示 Ag2SO4 的沉淀溶解平衡关系的曲线是________________ (填“a”、“b”)
②Ksp(Ag2SO3)为________________mol3L-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述正确的是
A.离子的还原性:C3-<D-B.离子半径:C>D>B>A
C.原子序数: d>c>b>aD.单质的还原性: A>B>D>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com