
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
分析 短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,
A.A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故A正确;
B.aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,所以原子序数为a>b>d>c,故B错误;
C.aA2+、bB+、cC2-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径C2->D->B+>A2+,故C错误;
D、同周期自左而右元素非金属性增强,离子的还原性减弱,离子的还原性:D -<C 2-,故D错误;
故选A.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | F | |||
| 3 | G | H | I | J | K | L | M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
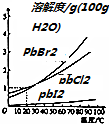
| A. | 三种卤化铅的溶解度均随温度的升高而减小 | |
| B. | 20℃时,PbCl2的Ksp约为1.87×10-4 | |
| C. | 任何温度下,始终存在:Ksp(PbCl2>Ksp(PbBr2>Ksp(PbI2) | |
| D. | 常温下,向浓度均为0.1mol•L-1的Cl-、Br-、I-混合溶液中,逐滴加入的Pb(NO3)2溶液,PbCl2最先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
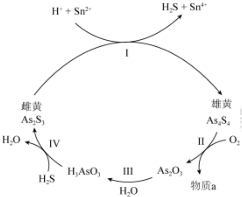
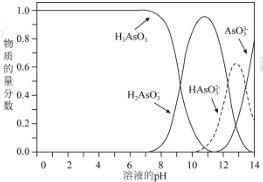
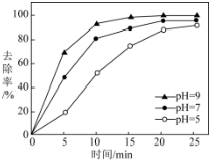
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ②④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦⑧ | B. | ③④⑤⑥⑦ | C. | ①④⑤⑥⑦⑧ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
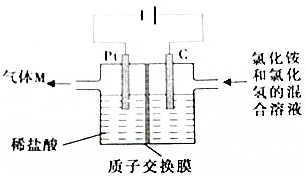 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )| A. | 每生产1molNCl3,理论上有4molH+经质子交换膜有右侧向左侧迁移 | |
| B. | 可用湿润的淀粉纸质检验气体M | |
| C. | 石墨极的电极反应式为NH4++3Cl--6e-=NCl3+4H+ | |
| D. | 电解过程中,质子交换膜右侧溶液的pH会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com