
【题目】0.4mol氯化铬(CrCl3·6H2O)在水溶液中加入过量硝酸银溶液,产生0.8mol AgCl沉淀。此氯化铬最可能是( )
A. [Cr(H2O)6]Cl3 B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O D. [Cr(H2O)3Cl3]·3H2O
科目:高中化学 来源: 题型:
【题目】(1)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。

①在图示的转化中,化合价不变的元素是_________________。
②反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为_________________。
(2)已知硫有多种同素异形体,如S2 、S4、 S6 、S8等。H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为_______________________。

(3)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7. 1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是____________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于皂化反应的是
A. 乙酸乙酯在碱性条件下水解 B. 硬脂酸甘油酯在酸性条件下水解
C. 软脂酸甘油酯在酸性条件下水解 D. 硬脂酸甘油酯在碱性条件下水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
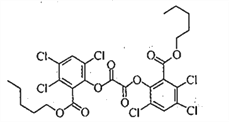
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的。

下列有关说法正确的是
A. 第①步中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸
B. 从第③步到第⑤步的目的是浓缩、富集溴
C. 第①到第⑤步中,涉及到氧化还原反应共有2步
D. 第④步中,SO2起氧化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 戊烯共有5种同分异构体,它们的熔点、沸点各不相同
B. 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
C. 1mol油脂完全水解生成1mol甘油和3mol高级脂肪酸(盐)
D. 聚合物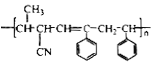 可由单体
可由单体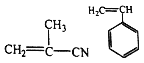 和
和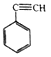 加聚制得
加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D ②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲:![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
乙:![]() 无色,无气味并且易燃。是常见的一种基础能源。
无色,无气味并且易燃。是常见的一种基础能源。
丙:![]() 有强氧化性的弱酸,可以用于消毒杀菌。
有强氧化性的弱酸,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)B元素在元素周期表中的位置为________________,请写出BC2分子的电子式:_______________。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生反应:_____________________________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生反应:______________________________________________________。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液。滴加过程中的现象为:
①试管中溶液变成深棕黄色,发生反应的离子方程式为 ;
②开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀。请回答“片刻后反应变得剧烈”的原因是a b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)及其化合物是用途广泛的化工原料,硼可与多种元素形成化合物。
(1)B的价电子轨道表示式为________ 。
(2)BF3与NH3可以通过配位键形成NH3·BF3。
① 基态![]() 原子的核外电子有________种不同的运动状态
原子的核外电子有________种不同的运动状态
② NH3 的键角________CH4的键角(填“大于”、“小于”或“等于”)。BF3为________分子(填“极性”或“非极性”)。
③ 在NH3·BF3所形成的配位键中,________原子提供空轨道。
(3)氮化硼(BN)晶体有多种结构。六方氮化硼与石墨相似,具有层状结构;立方氮化硼与金刚石相似,具有空间网状结构。它们的晶体结构如下图所示。

① 六方氮化硼和立方氮化硼中,B原子的杂化方式分别为_______、_______。
② 六方氮化硼能像石墨一样做润滑剂,原因是_______;但它不能像石墨一样导电,可能的原因是_______.
③ 已知立方氮化硼的晶胞参数(即晶胞的边长)为acm,则立方氮化硼的密度为_______g/cm3(只要求列算式,不必计算出结果,阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com