
ij��У��ʦҪ��ѧ������0.1 mol/L��KMnO4��Һ100mL���������ʵ�顣
��ʵ��һ���о��¶ȶԷ�Ӧ���ʵ�Ӱ�죬ѧ��ȡ��ֻ�Թܣ�������4mL 0.1 mol��L��KMnO4������Һ��10mL 0.1mol/L H2C2O4(�Ҷ���)��Һ����A�Թ�������ˮ�У�B�Թ�������ˮ�У���¼��Һ��ɫ�����ʱ�䡣Ҫ�� ���ữKMnO4��Һ����ɫ����ʱ��tA tB(�>������=����<��)��д���˷�Ӧ�����ӷ���ʽ�� ��
��ʵ������ⶨij�Ҷ�����Һ��Ũ�ȣ��������Ϊ��
(1)�ζ���ȷ��ȡ25.00 mL�Ҷ�����Һ����ƿ�У����������ữ����KMnO4��Һװ��________(���ʽ����ʽ��)�ζ��ܣ����еζ���������ʵ���з��֣��յ�������KMnO4��Һʱ����ҺѸ�ٱ���Ϻ�ɫ������ƿҡ��һ��ʱ����Ϻ�ɫ������ʧ ���ټ����μ�ʱ���Ϻ�ɫ�ͺܿ���ɫ�ˡ�
���ټ����μ�ʱ���Ϻ�ɫ�ͺܿ���ɫ�ˡ�
�����ԭ�� ������ ��֤���ﵽ�ζ��յ㡣
(2)���㣺���ظ���������2�Σ���¼ʵ���������¡�
��� | �ζ�ǰ����(mL) | �ζ������(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.00 | 22.10 |
����Ҷ�����Һ��Ũ��Ϊ ��
(3) �����������в����ᵼ���Ҷ�����ҺŨ��ƫ�ߵ��� ��
A�� ����KMnO4��Һ����ʱ�����ӹ۲�̶���
B��δ�ô���Һ�Ҷ�����ϴ�ζ���
C���ζ�ǰ��ƿ������ˮ
D���ζ�ǰ�ζ��ܼ��첿�������ݣ��ζ���������ʧ
E���ζ�ʱ����ƿ����Һ�ɽ���ȥ
F���۲����ʱ���ζ�ǰ���ӣ��ζ�����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ�߶������л�ѧ���������棩 ���ͣ�ѡ����
����������ȷ����
A��95�洿ˮ��pH<7��˵�����ȿɵ���ˮ������
B��25��ʱ���ڴ�ˮ�м���ǿ����Һ����Ӱ��ˮ�����ӻ�����
C��pH��3�Ĵ�����Һ��ˮϡ��10����pH��4
D��pH=3��pH=5�������10mL���������Һ��pH=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ�߶������л�ѧ���������棩 ���ͣ�ѡ����
��ӦA(g)+3B(g) 2C(g)+2D(g), �����ֲ�ͬ����µķ�Ӧ����, ���з�Ӧ����������( )
2C(g)+2D(g), �����ֲ�ͬ����µķ�Ӧ����, ���з�Ӧ����������( )
A��v(D)=24mol��L-1��min-1
B��v(C)=0.5mol��L-1��s-1
C��v(B)=30mol��L-1��min-1
D��v(A)=0.15mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ɹŸ������¿��Ļ�ѧ���������棩 ���ͣ�ʵ����
ij�о���ѧϰС��̽��FeSO4�Ļ�ѧ���ʺ���;���ش��������⣺
��1��̽��FeSO4��Һ������ԣ�ȡ����FeSO4���壬����ʯ����Һ����FeSO4��Һ������ԣ�����ѡ�õ������н�ͷ�ιܡ�ҩ�� ��
A�������� B���Թ� C����ƽ D����Ͳ
��2��������ͼװ��̽��FeSO4���ȶ���
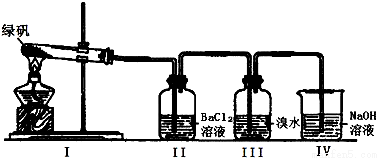
��II���а�ɫ�������ɣ�С���Ա������۷�������Ϊ���зֽ���ﲻ���� ���� ��
���� ��
A��Fe2O3 ��SO3 ��H2O
B��Fe2O3 ��SO2 ��SO3 ��H2O
C��FeO ��Fe2O3 ��SO2 ��SO3 ��H2O
��III����ˮ�����������Ƿ���SO2�������ɣ�����SO2���ɣ���ˮ����ɫ��ʵ���У��۲쵽��ˮ��ɫ���ݴ��Ʋ�FeSO4�ֽ����п��ܱ�������Ԫ���� ��
��NaOH������������SO2���壬��д�����������SO2����ķ�Ӧ��ѧ����ʽ�� ��
��3��̽��FeSO4��Fe2+��ԭ�ԣ�
֤��FeSO4�н�ǿ�Ļ�ԭ�ԣ�����±���
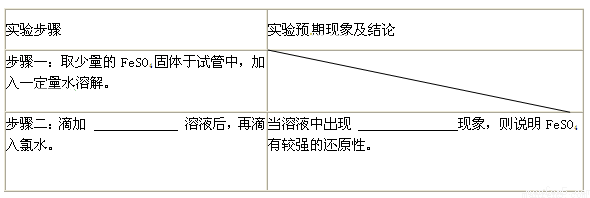
��4������������;̽��
ȱ����ƶѪ�����ڷ������������������������Ƴ�ҩƬʱ���������һ����������£��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ɹŸ������¿��Ļ�ѧ���������棩 ���ͣ�ѡ����
������Ԫ��W��X��Y��Zԭ��������������X��ԭ�Ӱ뾶���Ķ�����Ԫ�أ�Yԭ�������������͵��Ӳ�����ȣ�W��Zͬ������ԭ������֮����X��Yԭ������֮����ȡ�����˵���в���ȷ����
A. ��YԪ�ص�����Һ�ɳʼ���
B. X��W�γɵĻ�����ɺ��Ǽ��Թ��ۼ�
C. Y������Z������������Ӧˮ���ﷴӦһ������H2
D. W����̬�⻯�����ȶ���ǿ��Z����̬�⻯�����ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ������ģ��һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ԭ���������������W��X��Y��Z���ֶ���������Ԫ�أ�W-�뺤ԭ�ӵ��Ӳ�ṹ��ͬ��W��Xԭ�Ӻ�������������֮����Yԭ�Ӻ���������������ȣ�X��Y����ͬһ���ڣ�Y�ǵؿ��к�������Ԫ�أ�Zԭ�Ӵ�����������������������4��������˵����ȷ����
A. �����ӵİ뾶��X>Y>Z>W
B. ��W��X��Y����Ԫ����ɵĻ�����ˮ��Һһ��������
C. ��X��Y��Z����Ԫ���γɵĻ�����������ڹ��ۻ�����
D. ��W��Y����Ԫ���γɵĻ�������һ��ֻ���м��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ������ģ��һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶�ʱ��ˮ��Kw=10-13��p H=11��NaOH��ҺaL��pH=1��H2SO4��ҺbL��ϣ������û����ҺpH=2����a��bΪ
H=11��NaOH��ҺaL��pH=1��H2SO4��ҺbL��ϣ������û����ҺpH=2����a��bΪ
A��9:2 B�� 90:11 C�� 19:2 D��2:9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʦ���и�����ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ϊ��ʵ����ˮ���Ρ���ij�������ۺϴ�����NH4+��ˮ��ҵ����(��Ҫ��N2��CO2��SO2��NO��CO�������������ɷ�)��������������̣�
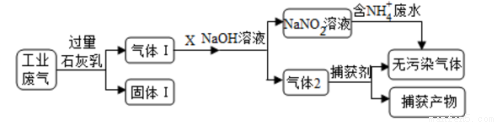
����˵������ȷ����( )
A������1����Ҫ����Ca(OH)2��CaCO3��CaSO3
B��X�����ǿ������������
C��������������������Ҫ��CO
D��������NH4+��ˮʱ��������Ӧ�����ӷ���ʽΪ��NH4++NO2-=N2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ¦���е���У�߶������л�ѧ���������棩 ���ͣ�ѡ����
Zn��ԭSiCl4�ķ�Ӧ���£�
SiCl4(g)+2Zn(l) Si(s)+2ZnCl2(g)��H1
Si(s)+2ZnCl2(g)��H1
SiCl4(g)+2Zn(g) Si(s)+2ZnCl2(g)��H2
Si(s)+2ZnCl2(g)��H2
����˵����ȷ����
A��Zn(l)=Zn(g)��H=1/2����H1-��H2��
B���ù�������̫���ܵ���ǽ���ѧ��ת��Ϊ����
C������Zn(g)��������H2�� ��
��
D����ZnƬ��ͭƬ��ϡ���ṹ�ɵ�ԭ��أ�ZnƬ���������ݲ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com