
| A. | 稀硫酸 | B. | 醋酸 | C. | 稀氨水 | D. | 饱和食盐水 |
科目:高中化学 来源: 题型:选择题
| A. | Na2O与水反应:O2-+H2O=2OH- | |
| B. | FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | NaHSO4溶液中加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| D. | Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化时,分子中H-O键发生断裂 | |
| B. | 原子晶体中,共价键越强,熔点越高 | |
| C. | 分子体中,共价键键能越大,该分子晶体的熔、沸点一定越高 | |
| D. | 分子晶体中,分子间作用力越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量CO2气体:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4 HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2Ag═Cu+2Ag+ | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | 2Fe+6H+═2Fe3++3H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | 用Na2SiO3溶液制备木材防火剂 | D. | 用K2FeO4作为高效水处理剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
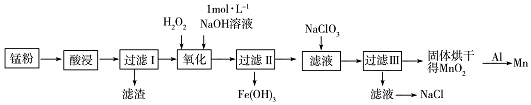
 ,NaClO3中所含的化学键类型有离子键和共价键.
,NaClO3中所含的化学键类型有离子键和共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com