
某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究.
(1)提出假设
①气体产物是CO2.②气体产物是CO.③气体产物是________.
(2)设计方案
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
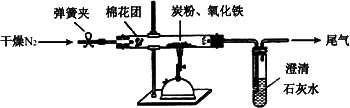
(3)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式:________.
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20 g氧化铁、2.00 g碳粉混合均匀,放入48.48 g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24 g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00 g.
步骤②、④中都分别通入N2,其作用分别为________.
(5)数据处理
试根据实验数据分析判断,前面的假设________(填①、②、③)是正确的.写出该实验中氧化铁与碳发生反应的化学方程式:________.
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省皖北协作区髙三年级联考化学试卷(解析版) 题型:实验题
二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设 不成立。
(2)若假设二成立,反应的化学方程式是 。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
|
实验步骤 (不要求写具体操作过程,仪器任选) |
预期的实验现象及结论 |
|
取适量的白色固体置于试管中,………… |
|
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由:
查看答案和解析>>
科目:高中化学 来源:专项题 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程:取一小块钠在空气中加热片刻后与一定量的水反应,收集到168 mL气体(标准状况下),在一定条件下将其引燃,恰好完全反应。下列说法错误的是 ( )
A.燃烧时出现黄色的火焰
B.将燃烧的产物溶于水发生置换反应,有单质H2和O2产生
C.燃烧产物中过氧化钠的质量为0.39 g
D.燃烧产物中钠和过氧化钠的物质的量之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com