
下列有关氧化还原反应的叙述正确的是( )
|
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 |
|
| B. | 在CaH2+2H2O═Ca(OH)2+2H2↑中,1 mol水得到1mol电子 |
|
| C. | 氧化还原反应的特征是电子的转移 |
|
| D. | 得电子的反应物在反应中作氧化剂,反应中被还原 |
| 氧化还原反应.. | |
| 专题: | 氧化还原反应专题. |
| 分析: | A.有单质参加或有单质生成的反应,不一定存在元素的化合价变化; B.在CaH2+2H2O═Ca(OH)2+2H2↑中,只有H元素的化合价变化,水中H得到电子; C.氧化还原反应的本质为电子的转移; D.氧化剂在反应中得到电子. |
| 解答: | 解:A.有单质参加或有单质生成的反应,不一定存在元素的化合价变化,如氧气与臭氧的转化,不属于氧化还原反应,故A错误; B.在CaH2+2H2O═Ca(OH)2+2H2↑中,只有H元素的化合价变化,水中H得到电子,则1 mol水得到1mol×(1﹣0)=1mol电子,故B正确; C.氧化还原反应的本质为电子的转移,其特征为化合价的变化,故C错误; D.氧化剂在反应中得到电子,被还原,发生还原反应,故D正确; 故选BD. |
| 点评: | 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,选项A为易错点,题目难度不大. |


科目:高中化学 来源: 题型:
茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)C中官能团的名称:_________________;
(2)反应②的反应类型为: ,反应③的反应类型为: ;
(3)写出反应①的化学方程式:_________________________________________________;
写出反应③的化学方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属元素特征的叙述正确的是( )
|
| A. | 金属元素的原子只有还原性,其阳离子只有氧化性 |
|
| B. | 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强 |
|
| C. | 钠元素在自然界中以化合态存在 |
|
| D. | 金属元素的单质在常温下都为固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
|
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
|
| B. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA |
|
| C. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA |
|
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同条件下,相同浓度的盐酸分别与镁、铝、铁3种金属恰好完全反应,产生相同体积的氢气(相同状况下),则下列说法正确的是( )
|
| A. | 开始时,产生氢气的速率相同 |
|
| B. | 参加反应的金属的质量相同 |
|
| C. | 所得溶液的质量相等 |
|
| D. | 参加反应的金属的质量比为12:9:28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O→Y+H2;Z+H2O→W+O2 (方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
|
| A. | X>Y、Z>W | B. | X<Y、Z<W | C. | X>Y、Z<W | D. | X<Y、Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)=2CO2 (g) △H= -566 kJ.mol-1
 Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g) △H= -226 kJ.mol-1
Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g) △H= -226 kJ.mol-1
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H= - 452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2x6.02×l023
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如图所示。请回答下列问题:
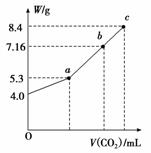
(1)b点时M的组成成分为____________________。
(2)若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________L(标准状况下)。
(3)若向生成的7.16 g盐的溶液中加入一定量的某物质,充分反应后,减压低温蒸发得到纯净的碳酸钠固体(无结晶水)8.4 g。
①若只加入0.03 mol某物质,则加入的物质可以是________或________。
②若只加入0.06 mol某物质,则加入的物质可以是________、________或________。
(4)常温下,同浓度的碳酸钠溶液和碳酸氢钠溶液的pH都大于7,二者中________的pH更大,理由是__________
________________________________________________________________________;
0.1 mol·L-1碳酸钠溶液中离子浓度的大小关系是
________________________________________________________________________;
向碳酸氢钠溶液中逐滴滴入氢氧化钡溶液,发生反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com