
| 实验试剂 | 实验结论 | ||
| 甲 | 乙 | 丙 | |
| ① | 高锰酸钾 | ② | 氧化性:KMnO4>Cl2>Br2 |
| 试剂甲 | 试剂乙 | 试剂丙 | 丙中现象 | 实验结论 |
| ______ | ______ | ______ | ______ | ______ |

| 试剂甲 | 试剂乙 | 试剂丙 | 丙中现象 | 实验结论 |
| 盐酸 | 石灰石 | 澄清石灰水或硅酸钠 | 变浑浊 | 酸性为:盐酸>碳酸,或盐酸>碳酸>硅酸 |


科目:高中化学 来源:不详 题型:实验题
 某研究性小组借助A-D的仪器装置完成有关实验
某研究性小组借助A-D的仪器装置完成有关实验

 【实验一】收集NO气体。
【实验一】收集NO气体。 用装置A收集NO气体,正确的操作上 (填序号)。
用装置A收集NO气体,正确的操作上 (填序号)。 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气 【实验二】为了探究镀锌薄铁板上的锌的质量分数
【实验二】为了探究镀锌薄铁板上的锌的质量分数 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。 (2)选用B和 (填仪器标号)两个装置进行实验。
(2)选用B和 (填仪器标号)两个装置进行实验。 (3)测得充分反应后生成氢气的体积为VL(标准状况),
(3)测得充分反应后生成氢气的体积为VL(标准状况),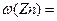 = 。
= 。 (4)计算镀层厚度,还需要检索的一个物理量是 。
(4)计算镀层厚度,还需要检索的一个物理量是 。 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。 (6)
(6)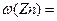 。
。 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。 (7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
(7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
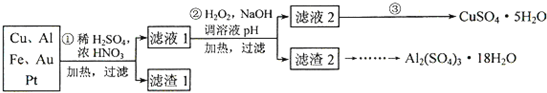
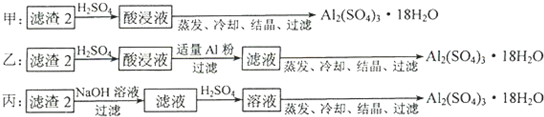
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④③ | B.④②①③ | C.②①③④ | D.④②③① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
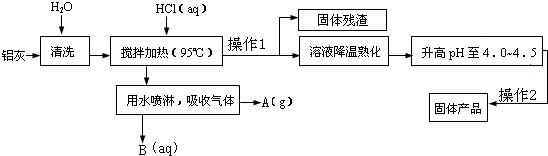
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
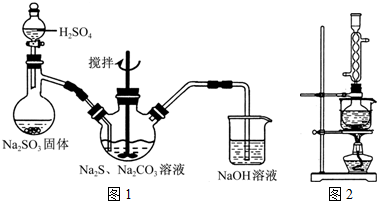
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验自来水中是否含氯离子 |
| B.鉴别食盐和纯碱 |
| C.检验鸡蛋壳能否溶于酸 |
| D.除去热水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | CO2 | HCl | 饱和Na2CO3溶液 |
| C | KCl溶液 | MgCl2 | 适量NaOH溶液 |
| D | FeCl2溶液 | CuCl2 | Fe粉 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com