

| A�� | �¶�Ϊ78��ʱ��������M�Ļ�ѧʽΪFeSO4•5H2O | |
| B�� | ȡ����380��ʱ���õ���ƷP����������������650�棬�õ�һ�ֹ�������Q��ͬʱ��������ɫ�������ɣ�Q�Ļ�ѧʽΪFe3O4 | |
| C�� | �ڸ������������£�N�õ�P�Ļ�ѧ����ʽΪFeSO4•H2O $\frac{\underline{\;����\;}}{\;}$FeSO4+H2O | |
| D�� | �¶�Ϊl59��ʱ����N�Ļ�ѧʽΪFeSO4•2H2O |
���� 8.34g FeSO4•7H2O��Ʒ���ʵ���=$\frac{8.34g}{278g/mol}$=0.03mol������m��H2O��=0.03mol��7��18g/mol=3.78g���羧��ȫ��ʧȥ�ᾧˮ�����������ӦΪ8.34g-3.78g=4.56g����P�Ļ�ѧʽΪFeSO4����֪�ڼ��ȵ�373��֮ǰ������ʧȥ���ֽᾧˮ����������ı仯��ȷ���ڲ�ͬ�¶�ʱ���Ⱥ����Ļ�ѧʽ��������633��ʱ�����������Ϊ2.40g������n��Fe��=n�� FeSO4•7H2O��=0.03mol��m��Fe��=0.03mol��56g/mol=1.68g���������m��O��=2.40g-1.68g=0.72g��n��O��=$\frac{0.72g}{16g/mol}$=0.045mol����n��Fe����n��O��=0.03mol��0.045mol=2��3�����������Q�Ļ�ѧʽΪFe2O3�����Ļ��ϼ����ߣ�������Ļ��ϼ۽��ͣ����ж����������ɣ���SO2��SO3�����ʵ����ֱ�Ϊx��y��������ԭ���غ㼰����������з��̼����ж��Ƿ������������Դ˽����⣮
��� �⣺8.34g FeSO4•7H2O��Ʒ���ʵ���=$\frac{8.34g}{278g/mol}$=0.03mol������m��H2O��=0.03mol��7��18g/mol=3.78g���羧��ȫ��ʧȥ�ᾧˮ�����������ӦΪ8.34g-3.78g=4.56g����P�Ļ�ѧʽΪFeSO4����֪�ڼ��ȵ�373��֮ǰ������ʧȥ���ֽᾧˮ��������633��ʱ�����������Ϊ2.40g������n��Fe��=n�� FeSO4•7H2O��=0.03mol��m��Fe��=0.03mol��56g/mol=1.68g���������m��O��=2.40g-1.68g=0.72g��n��O��=$\frac{0.72g}{16g/mol}$=0.045mol����n��Fe����n��O��=0.03mol��0.045mol=2��3�����������Q�Ļ�ѧʽΪFe2O3��
A���¶�Ϊ78��ʱ����������Ϊ6.72g������m��FeSO4��=0.03mol��152g/mol=4.56g��m��H2O��=6.72g-4.56g=2.16g��n��H2O��=$\frac{2.16g}{18g/mol}$=0.12mol����n��H2O����n��FeSO4��=0.12mol��0.03mol=4��1����ѧʽΪFeSO4•4H2O����100��ʱ��M�Ļ�ѧʽΪFeSO4•4H2O����A����
B��������������֪��P��ѧʽΪFeSO4��Q�Ļ�ѧʽΪFe2O3�����Ļ��ϼ����ߣ�������Ļ��ϼ۽��ͣ����ж����������ɣ���SO2��SO3�����ʵ����ֱ�Ϊx��y����$\left\{\begin{array}{l}{x+y=0.03}\\{64x+80y=4.56-2.4}\end{array}\right.$�����x=y=0.015�����Է���ʽΪ��2FeSO4 $\frac{\underline{\;����\;}}{\;}$Fe2O3+SO2��+SO3������B����
C���¶�Ϊl59��ʱ����������Ϊ5.10g������m��FeSO4��=0.03mol��152g/mol=4.56g��m��H2O��=5.10g-4.56g=0.54g��n��H2O��=$\frac{0.54g}{18g/mol}$=0.03mol����n��H2O����n��FeSO4��=0.03mol��0.03mol=1��1����N�Ļ�ѧʽΪFeSO4•H2O��P��ѧʽΪFeSO4���ڸ���������������N�õ�P�Ļ�ѧ����ʽΪ��FeSO4•H2O$\frac{\underline{\;373��\;}}{\;}$FeSO4+H2O����C��ȷ��
D��������������֪���¶�Ϊl59��ʱ����N�Ļ�ѧʽΪFeSO4•H2O����D����
��ѡ��C��
���� ���⿼�黯ѧ����ʽ�ļ��㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע��������ʵ������ı仯��ϵ���ܶ���ͼ�������غ�ĽǶȽ����⣬�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
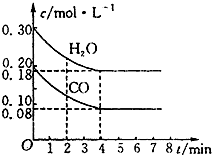 ��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0��CO��H2O��Ũ�ȱ仯��ͼ��ʾ��850��ʱ����Ũ�ȵı仯������0��4min��ƽ����Ӧ����v��CO��=0.03mol•L-1•min-1��
��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0��CO��H2O��Ũ�ȱ仯��ͼ��ʾ��850��ʱ����Ũ�ȵı仯������0��4min��ƽ����Ӧ����v��CO��=0.03mol•L-1•min-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ���С��մ��Ƥ���ϣ�������NaOH��Һϴ�� | |
| B�� | ʵ����������еķ�Һ������ˮ���ų�ʵ���ң�������Ⱦʵ���� | |
| C�� | ʵ������ȡ����ʱӦ�ȼ��װ�õ������� | |
| D�� | ��������ԭ����ͭ��ʵ��ʱ�ȼ�����ͨ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
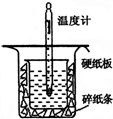 �к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�飮ȡ0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺
�к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�飮ȡ0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ICl��ˮ��Ӧ������ HCl �� HIO����1mol ICI �μӷ�Ӧת�Ƶ���Ϊ 1mol | |
| B�� | ij�¶���Һ̬IF5�������룺2IF5?IF4++IF6-��һ����c ��IF4+����c ��IF6-��=c ��IF5�� | |
| C�� | BrCl��Mg��Ӧ����MgCl2��MgBr2 | |
| D�� | XYn��±�ص���һ�����ǷǼ��Է��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��;���ٺ͢ڷֱ���ȡ1molFeCl2�������ϸ�����1molFe����ת��2mole- | |
| B�� | ��;���ۺֱܷ͢���ȡ1 mol Na2SO4�������ϸ�����1 molCl2����ת��2mole- | |
| C�� | ��;���ݺֱ͢���ȡ1 mol H2SO4�������ϸ�����1molS����ת��6mole- | |
| D�� | ����˵��������ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �ù㷺pH��ֽ��ñ�����ˮ��pHԼΪ2.2 | |
| B�� | ����Ͳ��ȡ7.60 mL 0.1 mol•L-1���� | |
| C�� | ��ͼ1��ʾ�IJ����ɼ��װ�õ������� | |
| D�� | ʵ������ͼ2��ʾ��װ����ȡ������NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܽ� ������BaCl2��Һ ���� | |
| B�� | �ܽ� ������CaCl2��Һ ���� | |
| C�� | �ܽ� ������Ca��OH��2��Һ ���� | |
| D�� | �ܽ� ���������� ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com