
分析 (1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,生成硝酸铜体现酸性;
(2)n(Cu)=$\frac{64g}{64g/mol}$=1mol,结合电子守恒计算被还原的HNO3的质量;
(3)反应前后原子个数不变,以此计算.
解答 解:(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,由生成硝酸铜体现酸性可知,8molHNO3参加反应,6mol作酸,只有2mol作氧化剂,则参加反应的HNO3和作为氧化剂的HNO3的个数比为8:2=4:1,故答案为:4:1;
(2)n(Cu)=$\frac{64g}{64g/mol}$=1mol,由电子守恒可知被还原的HNO3的质量为$\frac{1mol×(2-0)}{(5-2)}$×63g/mol=42g,故答案为:42g;
(3)反应前后原子个数不变,则反应后的混合气体中N、O原子个数比为a:(a+2b),故答案为:a:(a+2b).
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题
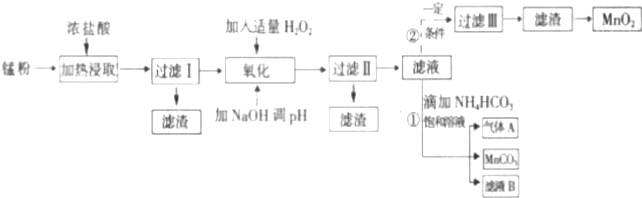
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁与稀硝酸反应来制备氢气 | |
| B. | 氨气、液氨和氨水是同一种物质 | |
| C. | NO2溶于水发生了氧化还原反应,它既是氧化剂又是还原剂 | |
| D. | 钠在氧气中燃烧发出白光,生成白色固体氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA | |
| B. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA | |
| C. | 常温常压下,20g D2O含有的原子总数为3NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合气体中分子总数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气与盐酸浓度相等 | B. | 盐酸有剩余 | ||
| C. | 溶液中[Cl-]=[NH+4] | D. | n(NH3)=n(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使溴水、酸性高锰酸钾溶液褪色,其反应类型相同 | |
| B. | 某烷烃R的相对分子质量为86,其氯代物只有2种,则R的名称一定为2,3-二甲基丁烷 | |
| C. | 若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物只有CHCl3 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
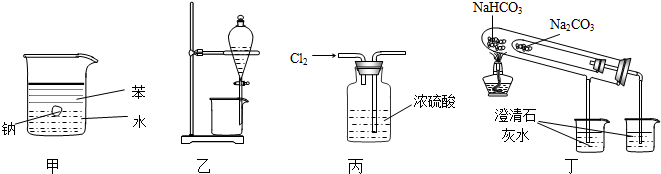
| A. | 用甲图装置证明密度ρ(苯)<ρ(钠)<ρ(水) | |
| B. | 用乙图装置分离酒精和四氯化碳 | |
| C. | 用丙图装置干燥Cl2 | |
| D. | 用丁图装置比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾做净水剂:Al3++3H2O═Al (OH)3↓+3H+ | |
| B. | 小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 漂白液加白醋,提高漂白效率:CH3COOH+ClO-═HClO+CH3COO- | |
| D. | 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I-+O2+2H2O═2I2+4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com