
【题目】下表为元素周期表中的一部分,表中列出了 11 种元素在周期表中的位置,按要求完成下列各小题。
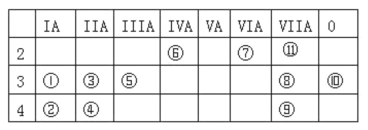
(1)化学性质最不活泼的元素是_____(填元素符号或化学式,下同),非金属性最强的单质与水反应的离子方程式是_______。
(2)①⑦⑧三种元素组成的化合物是84消毒液的主要成分,可以在碱性条件下处理含 CN-的废水,将CN-氧化成 CO32-和N2,写出反应的的离子方程式_____________________。
(3)用电子式表示③和⑧形成化合物的过程:________________。
(4)元素⑤的最高价氧化物与⑧的最高价氧化物对应的水化物反应的离子方程式为__________。
【答案】Ar 2F22H2O4HFO2 2CN5ClO2OH5Cl2CO32N2H2O ![]() Al2O36H 2Al33H2O
Al2O36H 2Al33H2O
【解析】
由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,为F,据此分析。
由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,为F。
(1)稀有气体的性质最稳定,化学性质最不活泼的元素是Ar;F的非金属性最强, F2与水反应生成HF与氧气,反应的离子方程式为:2F22H2O4HFO2;
(2)①⑦⑧三种元素组成的化合物是84消毒液的主要成分NaClO,可以在碱性条件下处理含CN-的废水,将CN-氧化成 CO32-和N2,ClO-被还原成Cl-,根据得失电子守恒、电荷守恒和原子守恒,反应的的离子方程式为2CN5ClO2OH5Cl2CO32N2H2O;
(3)用电子表示③和⑧形成化合物MgCl2的过程为:![]() ;
;
(4)元素⑤的最高价氧化物氧化铝与⑧的最高价氧化物对应的水化物高氯酸反应生成高氯酸铝和水,反应的离子方程式为Al2O36H 2Al33H2O。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:

下列说法正确的是
A. 离子半径的大小顺序:e>f>g>h
B. 与x形成简单化合物的沸点:y>z>d
C. x、z、d三种元素形成的化合物可能含有离子键
D. e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 16 g O2和O3的混合气体中含有的分子数为0.5NA
B. 0.3 mol AgNO3受热完全分解(2AgNO3===2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C. 100 mL 12 mol·L-1浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA
D. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物.又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z>H2W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞,则下列说法中正确的是

A. 超氧化钾的化学式为KO2
B. 每个晶胞中含有8个K+和4个![]()
C. 晶体中与每个K+距离最近的K+有8个![]()
D. 晶体中0价氧原子和-2价氧原子个数比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
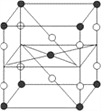
A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )

A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下:
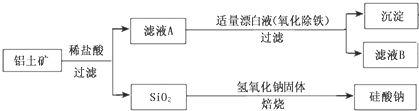
(1)加入盐酸时,氧化铝发生反应的离子方程式为______
(2)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。该过程中涉及某氧化还原反应如下,请完成:Fe2++___ClO-+ ═ Fe(OH)3↓+ Cl-+__________
Ⅱ、明矾在日常生活、生产中也占有一席之地。
(3)明矾是净水明星,用离子方程式表示其净水原理_____________________________。
(4)向0.02mol的明矾溶液中逐滴加入150mL0.2mol/LBa(OH)2溶液,生成沉淀的质量为 _____克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com