
 2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算: 2SO3(g) △H=-196 kJ/mol(计量系数和焓变值对应也行)
2SO3(g) △H=-196 kJ/mol(计量系数和焓变值对应也行) 2SO3(g)
2SO3(g)  2SO3(g) △H=-196 kJ/mol
2SO3(g) △H=-196 kJ/mol


科目:高中化学 来源:不详 题型:填空题
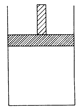
| A.容器不再与外界发生热交换 |
| B.混合气体的平均相对分子质量保持不变 |
| C.当V(N2)?:V(H2):?V(NH3)=1:?3?:2时 |
| D.当容器的体积不再发生变化时 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cu(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Cu(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
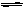 p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是
p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是 | A.m + n < p | B.平衡向逆反应方向移动 |
| C.A的转化率降低 | D.C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
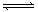 2C(g)在固定容积的容器中进行,如果向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1molC,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的( )
2C(g)在固定容积的容器中进行,如果向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1molC,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的( )| A.m>n | B.m<n | C. m=n | D.无法比较 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
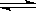 eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是( )
eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是( )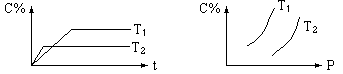
| A.m+n>e | B.m+n<e |
| C.正反应是吸热反应 | D.逆反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ??CO2(g)+H2(g) ΔH<0
??CO2(g)+H2(g) ΔH<0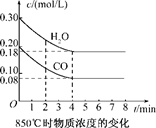
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com