
| A. | 铁和足量稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸钙和稀硝酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 稀硫酸和Ba(OH)2溶液反应:Ba2++H++SO42-+OH-═BaSO4↓+H2O | |
| D. | Cl2和FeCl2溶液反应:Cl2+Fe2+═Fe3++2Cl- |
分析 A.发生氧化还原反应生成NO;
B.反应生成硝酸钙、水、二氧化碳;
C.不符合离子的配比;
D.反应生成氯化铁,电子、电荷不守恒.
解答 解:A.铁和足量稀硝酸反应的离子反应为Fe+NO3-+4H+═Fe3++NO↑+2H2O,故A错误;
B.碳酸钙和稀硝酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故B正确;
C.稀硫酸和Ba(OH)2溶液反应的离子反应为Ba2++2H++SO42-+2OH-═BaSO4↓+2H2O,故C错误;
D.Cl2和FeCl2溶液反应的离子反应为Cl2+2Fe2+═2Fe3++2Cl-,故D错误;
故选B.
点评 本题考查离子反方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应的离子反应考查,题目难度不大.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | CCl4 和CH2Cl2 | B. | H3O+ 和NH4+ | C. | CaO2 和 CaF2 | D. | Ba(0H)2 和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4nb}{m{N}_{A}}$L | B. | $\frac{22.4mb}{n{N}_{A}}$ L | C. | $\frac{22.4n{N}_{A}}{mb}$ L | D. | $\frac{nb{N}_{A}}{22.4m}$ L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加Fe的量 | |
| B. | 将容器的容积缩小一半 | |
| C. | 保持容积不变,充入N2使体系压强增大 | |
| D. | 压强不变,充入N2使容器容积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 .
. B、
B、 C、
C、 D、
D、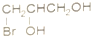
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com